INTRODUZIONE
Il dolore da arto fantasma è una sensazione dolorosa percepita in una parte del corpo che non esiste più, ed è una conseguenza comune che si verifica dopo amputazione e/o lesione nervosa (Herrador Colmenero et al., 2018; Kaur et al., 2018). Il dolore è tipicamente di origine neuropatica e riferito all’arto mancante; viene descritto come un dolore pulsante, pungente e bruciante; tra le sensazioni manifestate vi sono la presenza di spilli ed aghi, l’intorpidimento, il solletico, i crampi, la percezione mutevole di caldo e freddo nella zona amputata (Aternali et al., 2019; Herrador Colmenero et al., 2018; Kaur et al., 2018). L’insorgenza dei sintomi può essere provocata da cambiamenti ambientali, emotivi o fisici (Kaur et al., 2018); il tipo, la frequenza e la stabilità della percezione possono variare (Foell et al., 2011). Questo tipo di dolore può essere accompagnato da una varietà di effetti secondari, tra cui depressione, difficoltà nelle attività di vita quotidiana e diminuzione della qualità della vita (Aternali et al., 2019). Il dolore da arto fantasma è di solito riferito entro la prima settimana dopo l’amputazione; si tratta di un dolore cronico e in alcuni pazienti può gradualmente scomparire nel corso di pochi mesi fino ad arrivare ad un anno se non trattato, ma altri soffrono di dolore da arto fantasma per decenni (Aternali et al., 2019; Kaur et al., 2018). Negli Stati Uniti 1.7 milioni di persone ogni anno vengono sottoposte all’amputazione di un arto (Kaur et al., 2018); molte di esse riferiscono dolore all’arto fantasma ad un certo punto dopo l’amputazione e le stime di prevalenza sono comprese tra il 50 e l’85%. (Aternali et al., 2019; Dunn et al., 2017; Herrador Colmenero et al., 2018).
Fisiopatologia del dolore da arto fantasma
Sebbene ci siano diverse spiegazioni fisiopatologiche di rilievo per lo sviluppo del dolore da arto fantasma, la sua natura rimane poco chiara; si pensa che siano molteplici i meccanismi che stanno alla base di questo tipo di dolore e ciò ha reso difficile la sua gestione e un trattamento che si rivolge a più meccanismi di dolore da arto fantasma deve ancora essere sviluppato. (Aternali et al., 2019; Dunn et al., 2017). I meccanismi proposti sono tradizionalmente classificati in base al fatto che interessino il sistema nervoso periferico o centrale. I meccanismi periferici includono l’attivazione dei neuroni dell’arto residuo mediante stimolazione meccanica, catecolamine, fattori immunologici proinfiammatori e altre sostanze neurochimiche pronocicettive (Aternali et al., 2019; Dunn et al., 2017). Secondo altri ricercatori, è il sistema nervoso centrale il generatore principale del dolore da arto fantasma (Dunn et al., 2017; Luo et al., 2016). Tra i meccanismi centrali vi sono la riorganizzazione corticale disadattiva, il rilascio del controllo inibitorio e la perdita di input/feedback afferente dall’arto amputato. È stato suggerito che, dopo l’amputazione, le aree corticali che un tempo rappresentavano l’estremità amputata vengono rioccupate da zone adiacenti della corteccia somatosensoriale e motoria primaria corrispondenti ad altre parti del corpo (Aternali et al., 2019; Flor, 2002, Katz, 1992). A conferma di questa teoria è stato dimostrato che il dolore da arto fantasma è più intenso tra gli individui in cui è avvenuto un maggior grado di rimappatura corticale disadattiva (Aternali et al., 2019; Flor, 2002). Per quanto riguarda la mancanza di inibizione degli stimoli dolorosi, è stato ipotizzato che le vie centrali che normalmente inibiscono il sintomo potrebbero essersi ulteriormente ridotte dall’assenza di informazioni periferiche visive e tattili che, se presenti, potrebbero altrimenti confermare o meno la percezione del dolore (es. un arto fantasma in una posizione ritenuta dolorosa o una sensazione di “strisciamento” sulla cute) (Aternali et al., 2019; Katz, 1993). I fattori psicologici non sono stati ben supportati come fattori causali per il dolore da arto fantasma, ma è stato dimostrato che componenti psicologiche come lo stress e la depressione possono innescare ed aumentare un dolore già esistente (Dunn et al., 2017; Luo et al., 2016).
Trattamento del dolore da arto fantasma
L’approccio terapeutico per il dolore da arto fantasma dopo l’amputazione è molto complesso (Herrador Colmenero et al., 2018; Ramachandran et al., 1995; Ramachandran et al., 1998). Sono disponibili più di 25 trattamenti, ma nessuno è ampiamente accettato o chiaramente superiore agli altri (Aternali et al., 2019; Flor, 2002; Subedi et al., 2011). Questo probabilmente è dovuto ai molteplici meccanismi che contribuiscono a questo tipo di dolore. I trattamenti in genere mirano a un singolo meccanismo proposto, ma gli amputati possono avere dolore da arto fantasma che deriva da più meccanismi (Aternali et al., 2019). Le prove di efficacia per i trattamenti utilizzati per il dolore da arto fantasma sono scarse e la maggior parte degli studi di trattamento è sottodimensionata (Aternali et al., 2019).
Gli interventi includono la farmacoterapia, la terapia adiuvante e l’intervento chirurgico (Kaur et al., 2018). Per quanto riguarda l’approccio farmacologico, ci sono una varietà di farmaci tra cui scegliere inclusi antidepressivi triciclici, oppioidi e FANS. Il ricorso ad antidepressivi triciclici è uno dei trattamenti più comuni (Kaur et al., 2018). Gli interventi chirurgici più diffusi includono la neurectomia, il blocco dei nervi periferici, la revisione del moncone e il reinnervamento muscolare mirato (Aternali et al., 2019; Kaur et al., 2018). Sebbene gli interventi farmacologici siano ancora la prima linea di trattamento, gli effetti collaterali e i costi elevati ne ostacolano l’uso a lungo termine e il loro utilizzo è stato associato ad un aumento dei ricoveri ospedalieri, dei costi sanitari e dei decessi (Wittkopf et al., 2020). È importante dunque prendere in considerazione strategie alternative di gestione del dolore (Mallari et al., 2019). Sono state proposte numerose terapie adiuvanti, anche se nessuna di esse è risultata costantemente efficace. Tra queste troviamo: la stimolazione magnetica transcranica ripetitiva (rTMS), il biofeedback, la terapia elettroconvulsiva, l’agopuntura, il massaggio, la neuromodulazione e l’immaginazione motoria (Aternali et al., 2019; Dunn et al., 2017; Herrador Colmenero et al., 2018; Kaur et al., 2018). La rTMS è stata esplorata per il suo potenziale nel prevenire la rimappatura corticale sensomotoria disadattiva e nel ridurre quindi il dolore da arto fantasma. Colpendo la corteccia somatosensoriale e motoria con un impulso magnetico, si attivano vie inibitorie discendenti verso il talamo, modulando così i successivi segnali nocicettivi ascendenti e riducendo il dolore (Malavera et al., 2016).
La riorganizzazione corticale si pensa che sia alla base anche dell’immaginazione mentale, con l’ipotesi che i percorsi neurali coinvolti nell’esecuzione di movimenti reali si attivino quando si utilizza la propria immaginazione per spostare l’estremità fantasma (Aternali et al., 2019). L’immaginazione motoria coinvolge un complesso processo cognitivo, sensoriale e percettivo. Le azioni motorie sono attivate dal sistema nervoso centrale a livello della memoria di lavoro: questo produce una rappresentazione mentale del movimento senza alcun movimento fisico del corpo; in questo senso, la ricreazione volontaria di scene o compiti, chiamata “pratica mentale”, può migliorare le prestazioni motorie dell’individuo (Dickstein et al., 2007). Immaginare il movimento e percepire le sensazioni nell’arto perso può portare a un significativo sollievo dal dolore (Herrador Colmenero 2018). Alcune stimolazioni del sistema nervoso centrale come la stimolazione cerebrale profonda e la stimolazione del midollo spinale sono entrambe utili per alleviare il dolore da arto fantasma a vari gradi (Kaur et al., 2018; Subedi et al., 2011). I ricercatori hanno anche esplorato trattamenti che mirano ai meccanismi psicologici che mantengono il dolore come la terapia di desensibilizzazione e rielaborazione del movimento oculare (Eye Movement Desensitization and Reprocessing o EMDR). Si pensa che questa tecnica riduca il sintomo elaborando emotivamente i ricordi dolorosi che contribuiscono a mantenere questo tipo di dolore (Aternali et al., 2019). I trattamenti più promettenti riguardano le terapie a feedback visivo in cui i pazienti visualizzano l’arto mancante utilizzando specchi (Chan et al., 2007; Ramachandran et al., 1996), tecniche di realtà virtuale o video dell’arto intatto precedentemente registrati. Allo stesso tempo, i pazienti sono incoraggiati a sincronizzare il loro arto fantasma con i movimenti osservati (Giraux et al., 2003; Mercier et al., 2009).
La terapia a specchio per il dolore da arto fantasma
Il trattamento adiuvante ad oggi più utilizzato e studiato è la terapia dello specchio. Il feedback visivo a specchio, definito come terapia dello specchio, è stato proposto nei primi anni ’90 (Ramachandran et al., 1995) come trattamento per alleviare il dolore da arto fantasma negli amputati (Herrador Colmenero et al., 2018; Hoffman 2020). La terapia dello specchio prevede che il partecipante veda il riflesso del suo arto intatto che esegue vari compiti in uno specchio posto in una scatola in modo tale da indurre la percezione che sia invece l’arto amputato ad eseguirli ottenendo così un’illusione di funzionalità nell’area mancante (Grünert-Pluss et al., 2008; MacLachlan et al., 2004; McCabe et al., 2011; Tilak et al., 2016). Questo intervento induce vivide sensazioni di movimento dai muscoli e dalle articolazioni dell’arto colpito, riducendo la sensazione dell’arto fantasma e ottenendo il controllo motorio quando l’arto residuo è paralizzato. Il movimento dell’arto sano induce una sensazione di movimento nell’arto fantasma, riducendo in alcuni casi il dolore da arto fantasma (Ramachandran et al., 1995; Ramachandran et al., 1998). I meccanismi alla base dell’effetto della terapia a specchio non sono ancora chiari (Ramachandran et al., 2009) ma l’ipotesi è che il dolore da arto fantasma sia causato dal fatto che la rappresentazione mentale del corpo del paziente non si sia adattata alla nuova realtà, dunque il cervello invia ancora segnali all’arto amputato (Hoffman 2020; Ramachandran et al., 1996). Si pensa che questo trattamento riduca il dolore da arto fantasma ripristinando i normali imput somatosensoriali e visivi alle strutture cerebrali associate, migliorando lo squilibrio tra il sistema motorio e quello sensoriale (Aternali et al., 2019; Herrador Colmenero et al., 2018). Ciò potrebbe condurre ad una riorganizzazione corticale nella corteccia somatosensoriale dopo l’amputazione promuovendo la congruenza senso-motoria grazie alla visione di un arto sano e funzionale (Dunn et al., 2017; Wittkopf et al., 2020).
Altri autori affermano che l’efficacia della tecnica sta nel richiedere una maggiore concentrazione sull’arto doloroso, migliorando la percezione dell’arto stesso (Moseley, 2004). Inoltre, vedere l’arto tramite lo specchio ristabilisce, nelle strutture somatosensoriali e parietali, i normali processi di controllo inibitorio. Il ripristino del controllo inibitorio riduce l’attività cerebrale anormale e quindi il dolore (Aternali et al., 2019). Anche se la terapia dello specchio è un trattamento comunemente usato ed è stato valutato come metodo relativamente efficace di gestione non invasiva del dolore da arto fantasma, non ci sono prove sufficienti di alto livello per sostenere la sua efficacia (Barbin et al., 2016). La tradizionale terapia dello specchio soffre di limitazioni che ostacolano la sua efficacia: è semplice e ampiamente disponibile, ma può essere difficoltosa per i pazienti da autosomministrarsi correttamente e l’aderenza è scarsa perché è difficile, ripetitiva e non coinvolgente (Moseley et al., 2008).
Questa tecnica è limitata inoltre dai vincoli metodologici del realismo e del posizionamento fisico dello specchio ed è applicabile solo ad amputazioni unilaterali (Dunn et al., 2017; Kiabi et al., 2013). Inoltre richiede che il paziente rimanga con la testa rivolta verso lo specchio in una posizione relativamente fissa e deve ignorare l’arto intatto; questo metodo può creare un’illusione piuttosto restrittiva e provvisoria (Herrador Colmenero et al., 2018). I risultati degli studi più recenti che valutano l’efficacia della terapia dello specchio per la gestione del dolore da arto fantasma non sono promettenti: questa non sembra ridurre il dolore in misura maggiore rispetto al gruppo di controllo o ad altri trattamenti noti (Aternali et al., 2019). I ricercatori stanno attualmente sviluppando/esplorando l’uso di altre tecnologie per creare un’illusione più convincente al fine di aiutare a trattare il dolore da arto fantasma in modo più efficace (Hoffman et al., 2020).
La realtà virtuale per il dolore da arto fantasma
Una delle terapie più recenti e innovative è la realtà virtuale (RV). Questa utilizza il modello concettuale che sta alla base della terapia dello specchio (Dunn et al., 2017) ma ampliato in un’alternativa “high-tech”, che consente agli amputati di muovere il loro arto fantasma in modo indipendente mentre lo vedono interagire con l’ambiente circostante (Aternali et al., 2019). La rappresentazione virtuale di parti del corpo è utilizzata per creare l’illusione di un arto sano e funzionale e ridurre il dolore e i disturbi percettivi in arti dolorosi e dismorfici (Wittkopf et al., 2018; Wittkopf 2020). La RV è un ambiente artificiale e immersivo sperimentabile da un individuo attraverso un elmetto dotato di display, occhiali RV e cuffie insonorizzate (Aternali et al., 2019; Dunn et al., 2017). La realtà aumentata (RA) o non immersiva consiste invece in miglioramenti virtuali del mondo reale stratificati su video (Boyajian, 2015) per esempio con l’aggiunta dell’arto mancante (Aternali et al., 2019; Dunn et al., 2017). L’ambiente virtuale viene poi fornito all’individuo tramite un display montato sulla testa o lo schermo di un computer (Sharar et al., 2008; Wittkopf et al., 2020). Ciò che le persone vedono nella realtà virtuale cambia man mano che l’utente muove la testa per visualizzare l’ambiente e il proprio corpo avatar. Questo porta un’esperienza visiva in prima persona dell’arto virtuale attaccato al corpo virtuale.
Questa è la chiave per fornire potenti illusioni di proprietà/personificazione della rappresentazione virtuale del corpo (“il corpo dell’avatar che controllo nella realtà virtuale è il mio corpo”) (Hoffman et al., 2020; Serino et al., 2013). La RV permette di superare le limitazioni imposte dalla terapia dello specchio convenzionale. I movimenti dell’arto intatto infatti sono trasformati in movimenti virtuali dell’arto nello spazio occupato dall’arto fantasma, dando un’illusione simile a quella della scatola a specchio ma senza i limiti imposti dalla scatola di riflessione (Murray et al., 2006) in quanto nell’ambiente virtuale l’illusione è plausibile indipendentemente dall’orientamento del paziente (Murray et al., 2007). I movimenti degli arti inferiori di solito non sono simmetrici nelle attività della vita quotidiana, tranne in alcune attività come il nuoto. Lo specchio crea un’illusione simmetrica ma la RV può sviluppare un’immagine più appropriata, simile ai reali movimenti asimmetrici del vivere quotidiano (Cole et al., 2009). Inoltre, la RV rappresenta una forma di trattamento più coinvolgente rispetto ad altre terapie, il che ne può favorire l’aderenza (Aternali et al., 2019). Questa terapia può essere erogata anche sotto forma di giochi, che possono divertire e motivare ulteriormente il paziente (Hoffman et al., 2020). Recentemente è diventata disponibile in commercio una nuova opzione, costituita da occhiali di realtà virtuale immersiva con tecnologia di tracciamento del movimento oculare: videocamere in miniatura montate all’interno degli occhiali RV tracciano i movimenti degli occhi dei pazienti e possono dire al sistema di RV quali oggetti virtuali il paziente sta guardando nell’ambiente immersivo con cui sta interagendo (Hoffman et al., 2020).
L’interattività con la RV tramite il tracciamento oculare potrebbe essere particolarmente indicata ad esempio per i pazienti con mobilità limitata delle mani, i doppi amputati, i pazienti con ictus e quelli paralizzati totalmente o parzialmente (Hoffman et al., 2020). Tecnologie più complesse prevedono l’uso di telecamere a raggi infrarossi e sensori collegati al corpo dei partecipanti (Jansen-Kosterink et al., 2013). Il dolore cronico, tra cui rientra il dolore da arto fantasma, è un problema sanitario globale e un onere finanziario per i pazienti e i servizi sanitari (Breivik et al., 2013). Nello specifico, il dolore da arto fantasma è un problema mondiale (Kaur et al., 2018): l’alta prevalenza, gli elevati livelli di intensità del dolore e la diminuzione della qualità della vita associati al sintomo rendono importante esplorare nuove strade per prevenire e trattare questa condizione (Aternali et al., 2019). La RV si sta inserendo sempre di più nell’ambito medico, in modo particolare con il fine di modulare l’esperienza soggettiva del dolore (Wittkopf et al., 2020). Ad esempio, la RV è stata utilizzata per distrarre i pazienti da procedure dolorose (Chan et al., 2018) o esporli gradualmente a esercizi dolorosi (Pekyavas et al., 2017). La tecnologia RV immersiva sta dimostrandosi efficace come analgesico aggiuntivo non farmacologico per ridurre il dolore acuto, specialmente il dolore procedurale (Hoffman et al., 2020). C’è infatti una crescente evidenza che dimostra che la distrazione provocata dalla RV immersiva può aiutare a ridurre il dolore acuto come quello da cura delle ferite da ustione o da incannulamento di una vena periferica (Hoffman et al., 2020; Wittkopf et al., 2020).
C’è molta meno ricerca, ma un interesse crescente, sul fatto che la RV immersiva possa ridurre il dolore cronico persistente, come il dolore da arto fantasma (Hoffman et al., 2020). Prove preliminari suggeriscono che la distrazione della RV può ridurre temporaneamente alcuni tipi di dolore cronico, almeno durante il tempo in cui il paziente è immerso nella RV (Hoffman et al., 2020). L’intervento di RV ha il potenziale di ridurre significativamente il dolore cronico durante il periodo di esposizione (Mallari et al., 2019), ma ciò può dipendere dalla condizione clinica e dal tipo di intervento di RV utilizzato (Wittkopf et al., 2020). Presumibilmente, se usato semplicemente come tecnica di distrazione dal dolore, quando il paziente si toglie l’elmetto RV il dolore cronico può tornare. Ma al di là della finalità distrattiva, nuovi ambienti di RV specificamente progettati per aiutare a ridurre il dolore cronico potrebbero in teoria cambiare/migliorare permanentemente il modo con cui i pazienti percepiscono il dolore, anche dopo la rimozione dell’attrezzatura (Garcia-Palacios et al., 2015; Garrett et al., 2014; Keefe et al., 2012; Keefe et al., 2018). Inizialmente la maggior parte degli studi di analgesia con RV sono stati condotti in ambienti ospedalieri e universitari, utilizzando una tecnologia molto costosa.
Dal 2016 il costo di un sistema di RV è sceso drasticamente in quanto le principali aziende hanno iniziato a commercializzare in massa milioni di attrezzature di RV immersiva all’anno a costi accessibili per ottenere un maggiore profitto sulla vendita dei software di intrattenimento. La tecnologia per la RV è oggi ampiamente disponibile a prezzi contenuti e miliardi di dollari vengono attualmente investiti per il miglioramento e la produzione di massa (Hoffman et al., 2020). Gli esperti di tecnologia prevedono che le applicazioni mediche emergeranno come la più diffusa implementazione della realtà virtuale, seconda solo all’utilizzo per l’intrattenimento (Hoffman et al., 2020). Con l’aumento della disponibilità e il miglioramento della visualizzazione grafica delle tecnologie di RV, è probabile che queste verranno sempre di più utilizzate per il trattamento del dolore da arto fantasma. Allo stato attuale non risultano presenti in letteratura revisioni sistematiche finalizzate a verificare l’effetto della RV sul dolore da arto fantasma.
OBIETTIVO
Valutare l’efficacia della realtà virtuale sul dolore da arto fantasma nelle persone con amputazione.
METODI
Per rispondere all’obiettivo è stata implementata una revisione sistematica di sperimentazioni cliniche randomizzate, quasi randomizzate o non randomizzate con o senza gruppo di controllo. Il quesito clinico è stato strutturato nel rispetto del PICOS framework (Robinson et al., 2011) (Tabella 1).
Gli studi hanno dovuto soddisfare i seguenti criteri di inclusione: 1) Partecipanti – soggetti di qualsiasi genere ed età con una amputazione parziale o completa ad un arto, inferiore o superiore, affetti da dolore da arto fantasma; 2) Intervento – realtà virtuale ± altri interventi; 3) Controllo – nessun intervento, placebo, altri interventi; 4) Outcome – dolore da arto fantasma, valutato con qualsiasi strumento. La ricerca degli studi è stata effettuata sulle seguenti banche dati: Cochrane Library, MEDLINE (via PubMed), EMBASE (via Elsevier), CINAHL (via EBSCOhost), Web of Science (via Clarivate Analytics), Scopus (via Elsevier).
Tabella 1. – PICOS framework.
| P | Patient | Persone con amputazione |
| I | Intervention | Realtà virtuale ± altra terapia |
| C | Comparaison | Nessun intervento, placebo, altra terapia |
| O | Outcome | Dolore da arto fantasma |
| S | Study design | Revisione sistematica |
| Quesito clinico – Nelle persone con amputazione la realtà virtuale, in aggiunta o meno ad altra terapia, è più efficace nel ridurre il dolore da arto fantasma rispetto a nessun intervento, al placebo o ad altra terapia? | ||
Non sono stati posti limiti di lingua o data di pubblicazione. La strategia di ricerca implementata nei database biomedici è illustrata in Tabella 2. Per il recupero di ulteriori trial di interesse sono stati consultati anche i seguenti registri: International Clinical Trials Registry Platform, ClinicalTrials.gov, EU Clinical Trials Register, International Standard Randomised Controlled Trial Number registry. Questi registri sono stati interrogati lanciando la seguente stringa di ricerca: “virtual reality” AND “phantom limb”. Il rischio di bias degli studi inclusi è stato valutato con lo strumento Risk of Bias 2 (RoB 2) (Sterne et al., 2019).
Tabella 2. – Strategia di ricerca.
| Fonte | Strategia di ricerca | Limiti | Record |
| Cochrane Library | (MeSH descriptor: [Virtual Reality] explode all trees OR MeSH descriptor: [Virtual Reality Exposure Therapy] explode all trees) OR (“Virtual Reality Immersion Therapy” OR “Virtual Reality Therapy” OR “Virtual Reality Therapies” OR “Educational Virtual Realities” OR “Educational Virtual Reality” OR “Instructional Virtual Realities” OR “Instructional Virtual Reality” OR “User-Computer Interfaces” OR “User Computer Interface” OR “User Computer Interfaces” OR “Virtual Systems” OR “Virtual System” OR “Computer Simulations” OR “In silico Simulation” OR “Computerized Models” OR “Computerized Model” OR “Computer Models” OR “Computer Model” OR “In silico Models” OR “In silico Model” OR “Computational Modelling” OR “Computational Modeling” OR “In silico Modeling” OR “Video Game” OR “Computer Games” OR “Computer Game” “character user interface” OR “command-line interface” OR “command-line user interface” OR “computer user interface” OR “graphic user interface” OR “graphical user interface” OR “text user interface” OR “text-based user interface” OR “user-computer interface” OR computergame OR “television game” OR “TV games” OR “video games” OR videogame OR videogames )
AND MeSH descriptor: [Phantom Limb] explode all trees) OR (“Phantom Limb” OR “Phantom Limbs” OR “Phantom Sensation” OR “Phantom Sensations” OR Pseudomelia OR Pseudomelias OR “Phantom Limb Pain” OR “Phantom Limb Pains” OR “Phantom Pain” OR “Phantom Pains”) |
RCT | 1 |
| PubMed | “Virtual Reality”[Mesh] OR “Virtual Reality Exposure Therapy”[Mesh]
AND “Phantom Limb”[Mesh] |
“Clinical Trial” [Publication Type] | 2 |
| EMBASE | ‘virtual reality’/exp OR ‘virtual reality exposure therapy’/exp
AND ‘phantom limb’/exp |
‘clinical trial’/exp | 5 |
| CINAHL | (MH “Virtual Reality”) OR (MH “Virtual Reality Exposure Therapy”)
AND (MH “Phantom Limb”) |
(MH “Clinical Trials”) | 0 |
| Web of Science | “virtual reality” (Title)
AND “phantom limb” (Title) |
“clinical trial” (Topic) | 1 |
| Scopus | (TITLE (“virtual reality”))
AND (TITLE (“phantom limb”)) |
(TITLE-ABS-KEY (“clinical trial”)) | 1 |
RISULTATI
L’implementazione sui database biomedici della strategia di ricerca è stata eseguita l’11 aprile 2022 e ha condotto al recupero di 104 record. Al termine del processo di selezione dei record (Figura 1) (Page et al., 2021), sono stati ritenuti rilevanti per l’argomento in oggetto cinque trial.
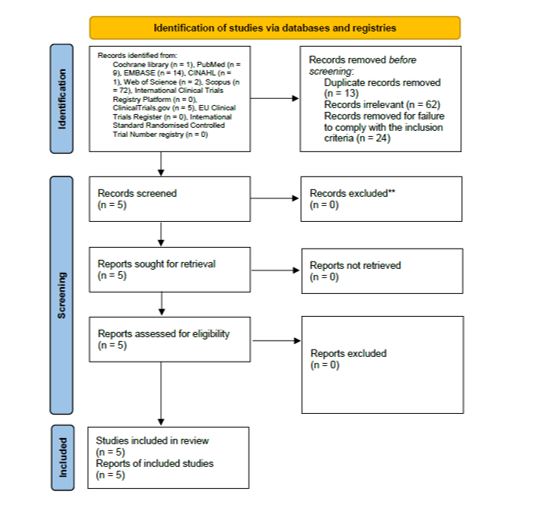
Figura 1. – Processo di selezione dei record.
Caratteristiche principali degli studi inclusi
Gli studi sono stati pubblicati tra il 2016 (Ortìz-Catalan et al., 2016) e il 2021 (Ambron et al., 2021). Due studi (Ambron et al., 2021; Ortìz-Catalan et al., 2016) sono trial clinici con gruppo sperimentale di convenienza e senza gruppo di controllo, uno (Ichinose et al., 2017) è un trial clinico crossover con gruppo sperimentale di convenienza, un altro (Rothgangel et al., 2018) è un RCT a gruppi paralleli e infine uno (Yanagisawa et al., 2020) è un RCT crossover. Due studi sono stati effettuati in Giappone (Ichinose et al., 2017; Yanagisawa et al., 2020), uno in Germania (Rothgangel et al., 2018), uno negli Stati Uniti (Ambron et al., 2021) e uno in Svezia e Slovenia (Ortìz-Catalan et al., 2016). Gli studi giapponesi sono stati condotti in un ambulatorio del Centro di Anestesiologia e Terapia del Dolore di un ospedale universitario di Tokio (Ichinose et al., 2017) e presso l’università di Osaka (Yanagisawa et al., 2020). I pazienti dello studio tedesco (Rothgangel et al., 2018) sono stati reclutati in sei cliniche di riabilitazione, due studi privati e un ospedale, quelli dello studio statunitense (Ambron et al., 2021) in tre ospedali della Pennsylvania e quello sloveno-svedese (Ortìz-Catalan et al., 2016) in tre cliniche in Svezia e una in Slovenia.
Tabella 3. Strategia di ricerca.
Nel complesso i partecipanti sono 117; lo studio a dimensione campionaria più ampia ha reclutato 75 soggetti (Rothgangel et al., 2018), quello con campione più piccolo solo 7 (Ambron et al., 2021). Il range di età è di 26-75 anni, quello relativo al tempo trascorso dall’amputazione è di 6 mesi-36 anni. In due studi (N=82) i partecipanti avevano un’amputazione all’arto inferiore (Ambron et al. 2021; Rothgangel et al., 2018) , negli altri tre i soggetti avevano subito l’amputazione all’arto superiore (N=35) (Ichinose et al., 2017; Ortìz-Catalan et al., 2016; Yanagisawa et al., 2020).
I criteri di inclusione degli studi su soggetti con amputazione dell’arto superiore erano i seguenti: dolore refrattario ad almeno un approccio clinico, assenza di variazione del dolore per almeno un mese dopo l’ultima sessione di trattamenti, presenza di una porzione controllabile dei muscoli bicipiti o tricipiti (Ortìz-Catalan et al., 2016); amputazione della mano o deafferentazione completa o mano completamente paralitica, normale comprensione e capacità intellettiva (Yanagisawa et al., 2020). Uno studio non ha dichiarato i criteri di inclusione (Ichinose et al., 2017). Per quanto riguarda i criteri di esclusione, due studi rispettivamente non li prevedevano (Ortìz-Catalan et al., 2016) o non li hanno dichiarati (Ichinose et al., 2017), mentre per uno studio erano i seguenti: avulsione incompleta delle radici, partecipanti non in grado di essere registrati con la magnetoencefalografia (MEG) (Yanagisawa et al., 2020). I criteri di inclusione degli studi su soggetti con amputazione dell’arto inferiore erano i seguenti: amputazione unilaterale dell’arto inferiore con dolore ≥ 3 e almeno un episodio di dolore alla settimana (Rothgangel et al., 2018) o dolore ≥ 4 nelle precedenti 4 settimane (Ambron et al., 2021), sufficienti capacità cognitive e comunicative e funzioni motorie adeguate (Rothgangel et al., 2018), amputazione sotto il ginocchio con lunghezza del moncone superiore a 10 cm almeno 4 mesi prima dell’arruolamento (Ambron et al., 2021). I criteri di esclusione erano i seguenti: anamnesi di ictus (Ambron et al., 2021; Rothgangel et al., 2018), dolore o limitazioni dei movimenti dell’arto intatto (Rothgangel et al., 2018), aver ricevuto più di sei sessioni di terapia dello specchio nei sei mesi precedenti (Rothgangel et al., 2018), lesioni traumatiche cerebrali moderate-gravi (Ambron et al., 2021), compromissione cognitiva significativa (Ambron et al., 2021; Rothgangel et al., 2018), sintomi di un disturbo psichiatrico maggiore in corso (Ambron et al., 2021), vivere a più di 50 km da un centro partecipante (Rothgangel et al., 2018).
Per quanto concerne gli interventi, negli studi i cui partecipanti avevano un’amputazione dell’arto superiore, essi sono stati sottoposti a: 1) dodici sessioni di esecuzione motoria dell’arto fantasma con posizionamento di elettrodi e fiducial marker ed esecuzione di movimenti in realtà aumentata e in realtà virtuale proposti sotto forma di giochi. Tutti i partecipanti hanno ricevuto il trattamento due volte a settimana tranne uno a cui è stata fornita un’erogazione quotidiana (Ortìz-Catalan et al., 2016); 2) esercizi di neuroriabilitazione in realtà virtuale (quando la rappresentazione virtuale dell’arto toccava un oggetto bersaglio, veniva applicato un feedback tattile alla guancia del paziente – condizione guancia – e un feedback uditivo). Il numero di sessioni variava in base alle condizioni del soggetto (es. motivazione, affaticamento, tempo) (Ichinose et al., 2017); 3) allenamento reale (i partecipanti dovevano muovere la mano fantasma visualizzata attraverso immagini virtuali; l’immagine si muoveva in base alla probabilità di movimento della mano valutata da un decodificatore attraverso segnali MEG – l’immagine era controllata in base alle attività corticali) (Yanagisawa et al., 2020). Le condizioni di controllo, se previste dallo studio, erano le seguenti: 1) feedback tattile applicato alla mano intatta (condizione mano intatta) o nessun feedback tattile (condizione nessuno stimolo) (Ichinose et al., 2017); 2) allenamento casuale (l’immagine è controllata da un valore che aumenta o diminuisce casualmente (Yanagisawa 2020). Per quanto concerne gli studi i cui partecipanti avevano un’amputazione dell’arto inferiore, essi sono stati sottoposti ai seguenti interventi: 1) trattamento degli arti inferiori in due fasi, nella prima con tecnica di distrazione tramite ambiente di realtà virtuale ma senza movimenti delle gambe, nella seconda con movimenti delle gambe per controllare gli arti virtuali durante la partecipazione a giochi. Il numero complessivo di trattamenti era costante ma variava il numero di sessioni di distrazione (Ambron et al., 2021); 2) terapia dello specchio tradizionale seguita da terapia dello specchio in realtà aumentata (primo gruppo), terapia dello specchio tradizionale seguita da terapia dello specchio autogestita (secondo gruppo).
La prima parte del trattamento prevedeva 10 sessioni di 30 minuti, nelle restanti 6 settimane i partecipanti potevano effettuare il trattamento ogni volta che lo desideravano (Rothgangel et al., 2018). Le condizioni di controllo, se previste dallo studio, erano le seguenti: esercizi sensomotori dell’arto intatto senza specchio seguiti da esercizi autogestiti. Anche in questo caso nella prima parte del trattamento erano previste 10 sessioni di 30 minuti e nelle restanti 6 settimane i partecipanti potevano effettuare il trattamento ogni volta che lo desideravano (Rothgangel et al., 2018). Negli studi i cui partecipanti erano affetti da amputazione all’arto superiore gli outcome valutati e i relativi strumenti di misura sono stati i seguenti: 1) outcome primari – intensità del dolore con Numerical Rating Scale – NRS (Ortìz-Catalan et al., 2016; Ichinose et al., 2017) o con Visual Analogue Scale – VAS (Yanagisawa et al., 2020), frequenza del dolore con scala ad hoc (Ortìz-Catalan et al., 2016); 2) outcome secondari – qualità del dolore con Short Form McGill Pain Questionnaire (Ortìz-Catalan et al., 2016; Ichinose et al., 2017), interferenza del dolore nelle attività di vita quotidiana con NRS (Ortìz-Catalan et al., 2016), disturbi del sonno e dell’umore correlati al dolore con NRS (Ortìz-Catalan et al., 2016). Negli studi i cui partecipanti erano affetti da amputazione all’arto inferiore gli outcome valutati e i relativi strumenti di misura sono stati i seguenti: 1) outcome primari – intensità del dolore con Short Form McGill Pain Questionnaire o Brief Pain Inventory (Ambron et al., 2021) oppure con NRS (Rothgangel et al., 2018), frequenza del dolore con scala a 6 punti (Rothgangel et al., 2018), durata del dolore con scala a 7 punti (Rothgangel et al., 2018); 2) outcome secondari – interferenza del dolore nelle attività di vita quotidiana con Brief Pain Inventory, 12-item Short Form Health Survey e Frenchay Activities Index (Ambron et al., 2021) o con Patient Specific Functional Scale e sette item del Pain Disability Index (Rothgangel et al., 2018), benessere psicologico, depressione e ansia con Hospital Anxiety and Depression Scale e Pain Catastrophizing Scale (Ambron et al., 2021), qualità della vita con EuroQol Questionnaire (Rothgangel et al., 2018), dimensioni del dolore con Neuropathic Pain Symptom Inventory (Rothgangel et al., 2018), cambiamenti nell’autoefficacia specifica per il dolore con Pain Self Efficacy Questionnaire (Rothgangel et al., 2018), disturbi del sonno e dell’umore correlati al dolore con NRS (Rothgangel et al., 2018), effetto complessivo del trattamento con Global Perceived Effect Scale (Rothgangel et al., 2018).
Per quanto concerne l’effetto degli interventi sugli outcome, negli studi i cui partecipanti avevano subito l’amputazione dell’arto superiore i risultati sono stati i seguenti: 1) l’intensità del dolore si è ridotta in modo statisticamente significativo (Ichinose et al., 2017; Ortìz-Catalan et al., 2016; Yanagisawa et al., 2020), 2) l’intrusione del dolore nelle attività di vita quotidiana si è ridotta in media del 43% (Ortìz-Catalan et al., 2016), 3) l’intrusione del dolore nel sonno si è ridotta in media del 72% (Ortìz-Catalan et al., 2016); negli studi i cui partecipanti invece avevano subito l’amputazione dell’arto inferiore i risultati sono stati i seguenti: 1) l’intensità del dolore si è ridotta in modo statisticamente non significativo (Ambron et al., 2021; Rothgangel et al., 2018), 2) l’intrusione del dolore nelle attività di vita quotidiana si è ridotta (Ambron et al., 2021), 3) la frequenza del dolore si è ridotta (Rothgangel et al., 2018).
Rischio di bias degli studi inclusi
Applicando la RoB 2 (Tabella 4 e Tabella 5), ne risulta che tutti gli studi inclusi sono complessivamente ad alto rischio di bias.
Tabella 4. – RoB 2: Summary light plot.
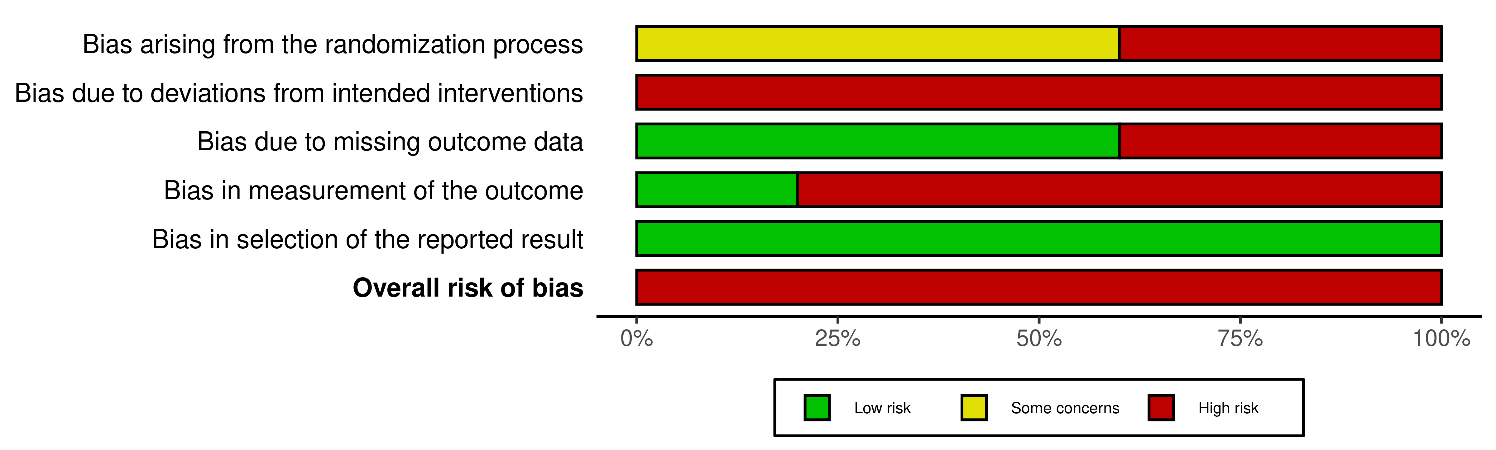
Tabella 5. – RoB 2: RoB 2: traffic light plot.

DISCUSSIONE
Risultati principali
Questa revisione sistematica si è proposta di valutare l’efficacia della RV sul dolore da arto fantasma nelle persone affette da amputazione. L’efficacia dell’intervento è stata valutata sia sull’intensità del dolore che sulla sua qualità, durata, frequenza, sul livello di interferenza nelle attività di vita quotidiana o sulla qualità del sonno. Tuttavia, solo l’intensità del dolore è stata misurata in tutti gli studi, quindi è possibile fornire un giudizio complessivo dell’efficacia della RV allo stato attuale solo per questo outcome. Negli studi i cui partecipanti (N=35) avevano subìto l’amputazione dell’arto superiore (Ichinose et al., 2017; Ortìz-Catalan et al., 2016; Yanagisawa et al., 2020), l’intensità del dolore si è ridotta in modo statisticamente significativo; in quelli invece i cui partecipanti (N=82) avevano subìto l’amputazione dell’arto inferiore (Ambron et al., 2021; Rothgangel et al., 2018), l’intensità è diminuita ma in modo statisticamente non significativo. Il trend promettente in direzione di una riduzione dell’intensità del dolore a seguito dell’implementazione della RV potrebbe essere legato in parte al ripristino della rappresentazione compromessa dell’arto che determinava l’incongruenza tra feedback sensoriale atteso e reale (Ambron et al., 2021). In effetti, il dolore da arto fantasma sembrerebbe indotto da un’integrazione sensomotoria incongruente associata a un arto mancante o non attivo (McCabe et al., 2005; Mc Cabe et al., 2007) e strettamente legato alla riorganizzazione della corteccia cerebrale (Knecht et al., 1998; Lotze et al., 2001).
A causa del legame funzionale riscontrato tra la riorganizzazione corticale e il dolore da arto fantasma, gli approcci terapeutici come la realtà virtuale che mirano a modificare la prima influenzano probabilmente anche il secondo (Birbaumer et al., 1997). Le teorie sulla riorganizzazione corticale post amputazione tendono a enfatizzare la deprivazione sensoriale come causa principale della riorganizzazione a scapito della deprivazione motoria; tuttavia, la corteccia motoria è altrettanto colpita in quanto in disuso e una parte importante delle aree motorie prima dedicate all’arto mancante può ancora essere impegnata per produrre movimenti (Ortiz-Catalan et al., 2016) In questa prospettiva, l’immaginazione motoria volontaria di un arto fantasma tramite la RV sembra giocare un ruolo importante nell’alleviare il dolore da arto fantasma (McCabe et al., 2005; Osumi et al., 2015; Osumi et al., 2017; Sumitani et al., 2008), come effetto della riattivazione della corteccia motoria primaria attraverso l’allenamento visuomotorio (Giraux et al., 2003).
Implicazioni per la pratica
Nonostante i risultati incoraggianti, l’intervento di RV allo stato attuale costa molto di più di interventi alternativi come la terapia a specchio. Non è da escludere però che in un futuro non lontano, al procedere di tecnologie più sofisticate a costi ancora più accessibili, possa avere una crescente diffusione nella pratica clinica e un ruolo sempre più intrusivo nel campo dell’algologia in generale e nella gestione del dolore cronico, incluso il dolore da arto fantasma, nello specifico. La riduzione di questo tipo di dolore sembra dipendere dalla qualità dell’illusione creata ed è proporzionale al livello di coinvolgimento proposto al paziente, legato all’immersività e all’interattività (Ambron et al., 2021; Herrador Colmenero et al., 2018). Se è di beneficio sul dolore, la realtà virtuale può anche diminuire lo stress situazionale che nei pazienti con chinesiofobia (=paura di eseguire movimenti, una delle conseguenze emotive del dolore da arto fantasma) si sviluppa all’interno del setting clinico (Herrador Colmenero et al., 2018).
Per massimizzare l’effetto, è raccomandabile che l’intervento sia adattato alle caratteristiche e alle specifiche esigenze e preferenze del paziente (Rothgangel et al., 2018). Sembra che all’aumentare del numero di sessioni di RV cresca il beneficio che, in alcuni soggetti, persiste per settimane o mesi (Ambron et al., 2021). Questo persistere del sollievo dal dolore da arto fantasma a distanza di tempo rende poco probabile che sia causato dall’effetto placebo (Ortiz-Catalan et al., 2016).
Implicazioni per la ricerca
È necessario compiere ulteriori ricerche finalizzate a esplorare l’effetto della RV 1) in un contesto acuto o subacuto quindi nelle prime fasi di insorgenza del dolore da arto fantasma (Ambron et al., 2021), considerando il fatto che un trattamento precoce è stato riconosciuto come fattore prognostico positivo (Casale et al., 2009); 2) per definire il timing ottimale dopo l’amputazione per l’applicazione dell’intervento (Herrador Colmenero et al., 2018); 3) in funzione del genere e dell’arto amputato. Studi precedenti mostrano infatti che la probabilità di presentare dolore da arto fantasma sembra più bassa negli uomini che nelle donne e si riduce nel tempo negli amputati agli arti inferiori rispetto agli amputati agli arti superiori (Bosmans et al., 2010); 4) in funzione dell’età. La plasticità neuronale è associata all’età, con conseguente progressiva distorsione e perdita di sensazioni e percezioni (Herrador Colmenero et al., 2018); inoltre, i fenomeni legati all’invecchiamento neuronale inducono cambiamenti nelle prestazioni psicomotorie, aumentando il tempo di reazione e diminuendo la velocità e la precisione dei movimenti e delle attività (WHO, 1981); 5) in funzione della frequenza e del tempo di esposizione dell’intervento. Ciò per verificare l’impatto sul dolore da arto fantasma e sugli effetti collaterali associati all’uso prolungato e ripetuto di tecnologie atte alla riproduzione della RV, come la cinetosi digitale (che determina nausea, vertigini, cefalea, senso di confusione) e il disorientamento (Wittkopf et al., 2020).
Limiti degli studi inclusi
Il rischio di bias complessivo, valutato con RoB 2, è alto per tutti gli studi; nello specifico, il punto focale consiste nella difficoltà, per la natura stessa dell’intervento, di mettere in cieco i partecipanti e i valutatori degli outcome. Questo è un aspetto molto importante perché è associato al rischio di bias degli esiti, specie per quelli soggettivi come la percezione del dolore (Wittkopf et al., 2020). A ciò si aggiunge il fatto che tre studi (Ambron et al., 2021; Ichinose et al., 2017; Ortiz-Catalan et al., 2016) non erano randomizzati, il che ha determinato un alto rischio di bias di selezione. Inoltre, sebbene la rappresentazione virtuale di parti del corpo sembri efficace nel trattamento del dolore da arto fantasma, prove conclusive possono essere ottenute solo conducendo RCT a gruppi paralleli, cioè con un gruppo di controllo che serva da riferimento per il gruppo sperimentale.
Purtroppo solo uno studio sui cinque inclusi aveva questa caratteristica (Rothgangel et al., 2018). A questi limiti, si aggiungono i seguenti: 1) campioni di piccole dimensioni; 2) ampio range di età (26-75 anni) e di tempo trascorso dall’amputazione (6 mesi-36 anni); 3) netta prevalenza del genere maschile (69-100%); 4) ampia eterogeneità in termini di a) criteri di inclusione ed esclusione, b) presentazione del sintomo (intensità, fattori di innesco, frequenza, durata e tipologia), c) modalità e caratteristiche procedurali di erogazione dell’intervento, d) configurazione hardware iniziale, e) durata delle sessioni di terapia, f) ambienti virtuali visualizzati, g) grado di immersione nella RV e livello di interazione con l’avatar, h) strumenti di valutazione degli outcome, i) durata del follow up. Da ultimo, per l’implementazione della RV è necessario il controllo volontario della muscolatura sul moncone, pertanto i pazienti con lesioni nervose per i quali non sia possibile stimolare l’attività muscolare non possono beneficiare dell’intervento, al pari di quelli con completa disarticolazione dell’arto in quanto non dispongono di muscolatura sufficiente per consentire la previsione dei movimenti distali (Ortiz-Catalan 2016).
Limiti della revisione
La strategia di ricerca è stata implementata sui principali database biomedici e la stringa di ricerca creata per la loro interrogazione si è servita delle parole chiave (MeSh Terms) del vocabolario controllato (thesaurus) delle singole risorse, qualora presente, e di parole chiave a testo libero. Non è stato interrogato il database biomedico PsycINFO, che forse avrebbe potuto rivelare altri studi di interesse, così come non è stata consultata la letteratura non pubblicata (letteratura grigia). Di contro, sono stati interrogati i principali registri di trial alla ricerca di studi appena completati ma non ancora pubblicati. Inoltre, non sono stati posti limiti alla data e lingua di pubblicazione.
CONCLUSIONI
L’effetto della realtà virtuale sull’intensità del dolore da arto fantasma nelle persone affette da amputazione sembra promettente. Tuttavia, a causa dell’alto rischio di bias e dei limiti manifestati dai trial disponibili, i risultati ottenuti sono scarsamente generalizzabili e da considerare con molta cautela, per la bassa fiducia sulla loro affidabilità. Occorrono ulteriori conferme sull’effetto positivo riscontrato sul dolore in termini di qualità, durata, frequenza, livello di interferenza nelle attività di vita quotidiana o sulla qualità del sonno.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.