INTRODUZIONE
Ogni anno nel mondo viene diagnosticata una neoplasia a quasi 400.000 bambini e adolescenti tra 0 e 19 anni; questa malattia rappresenta la seconda causa di morte al di sotto dei 15 anni e la quarta tra i 15 e i 19 anni (WHO, 2021). I soggetti a cui è stata diagnosticata una neoplasia sono sottoposti a ricorrenti procedure invasive, tra cui il prelievo venoso, l’accesso al port-a-cath, il prelievo di midollo osseo o la puntura lombare (Loeffen et al., 2020). La preoccupazione principale dei bambini con neoplasia è il dolore procedurale, che supera persino quella per il dolore correlato alla malattia (Hedström et al., 2003; Yap et al., 2020). Il 50-60% di essi, infatti, riferisce dolore e ansia durante queste procedure e quasi il 63% sviluppa una paura verso gli operatori sanitari (Miller et al., 2020).
Il dolore aggiunge ansia e paura al bambino ma, a loro volta, ansia e paura possono aumentare il dolore: esiste quindi una certa relazione tra dolore, ansia e paura sebbene sia difficile dire quale sia la causa e quale l’effetto (Czech et al., 2021). È comunque dimostrato che gli stimoli psicologici agiscono sulla sensazione di dolore; quindi la sofferenza mentale e fisica si associa all’aumento di intensità del dolore (Adam et al., 2018). Quando i bambini con neoplasia provano dolore, ansia o paura le procedure durano di più perché il personale sanitario dedica maggior tempo per calmarli e spesso queste devono essere ripetute più volte (Dìaz-Rodriguez et al., 2021). I genitori potrebbero anche costringere i propri figli e trattenerli affinché sia possibile completare la procedura (Jong et al., 2020). La mancata o inadeguata gestione del dolore e dell’ansia si associa alla maggiore sensibilità verso futuri stimoli dolorosi (Po’ et al., 2012). Inoltre, può aumentare il rischio di comportamenti di evitamento, tra cui una ridotta aderenza alle cure con conseguenti scarsi risultati del trattamento e progressione della malattia (Eijlers et al., 2019). L’evitamento delle procedure mediche è conseguenza anche del sentimento di paura che si rinnova al ricordo del dolore provato dal bambino (Noel et al., 2018). La paura è un’emozione negativa che si ritiene nasca come allarme per una situazione pericolosa e/o che potrebbe mettere a rischio la vita. La paura per le procedure mediche rappresenta una sottocategoria della paura nei bambini: in costoro, la paura è un’emozione comune che può essere indotta anche dalla memoria di esperienze negative. Tuttavia, a differenza di altri tipi di paura, quella per le procedure mediche potrebbe aumentare con l’età, all’avanzare del sistema di memoria esplicita (McMurtry et al., 2011).
Le linee guida dell’Organizzazione Mondiale della Sanità per la gestione del dolore oncologico raccomandano l’utilizzo di paracetamolo, farmaci antiinfiammatori non steroidei, steroidi e oppioidi (WHO, 2018) nonché il ricorso ad anestesia locale o generale e a sedativi (Koller et al., 2012). Tuttavia, benchè il trattamento farmacologico fornisca sollievo dal dolore, possono verificarsi effetti collaterali come allucinazioni, nausea, vomito, prurito, stipsi e depressione respiratoria. L’ansia viene trattata con benzodiazepine ma queste comportano complicanze come dipendenza, sedazione, tolleranza e interazione avversa con altri farmaci (Nerini et al., 2016). Inoltre, gli studi dimostrano che gli interventi farmacologici non sempre riescono a controllare il dolore e l’ansia (Gatlin et al., 2007). Per questo motivo le tecniche non farmacologiche, considerate più sicure, possono essere utilizzate come intervento complementare a quello farmacologico per trattare il dolore e l’ansia nei bambini con neoplasia (Ferrell et al., 2019; Nerini 2024; Platt et al., 2016; Taddio et al., 2010).
Negli ultimi anni gli studi si sono focalizzati sullo sviluppo di metodi efficaci di distrazione per la gestione del dolore e dell’ansia in ambito pediatrico facilmente integrabili nella pratica clinica (Birnie et al., 2014). La distrazione può essere un intervento non farmacologico alternativo in caso di procedure dolorose (McCaffery, 2002; von Baeyer et al., 2004) perché reindirizza l’attenzione del soggetto dalle esperienze di trattamento dolorose e spiacevoli verso quelle più piacevoli, lasciando a disposizione meno capacità cognitiva per l’elaborazione degli stimoli dolorosi (Piira et al., 2002). In oncologia pediatrica i metodi di distrazione includono l’uso di musica, massaggi, esercizi di respirazione, ipnosi e terapia cognitivo-comportamentale (Birnie et al., 2018; Facchini et al., 2021; Ferreira et al., 2015; Nunns et al., 2018; Thi et al., 2022). Tuttavia, tali interventi di distrazione sono spesso implementati in modo subottimale nella pratica clinica in quanto richiedono molto tempo e una formazione adeguata (Comparcini et al., 2023).
Con lo sviluppo della tecnologia un metodo di distrazione innovativo e sempre più promosso e utilizzato in ambito clinico è rappresentato dalla realtà virtuale (Czech et al., 2021). Per realtà virtuale (RV) si intende un sistema di simulazione a 3D generato da un computer in cui un individuo può interagire ed eseguire una serie di azioni in un ambiente virtuale sentendosi immerso in esso a tal punto da percepire di viverci realmente (Eijlers et al., 2019; Ozturk et al., 2023). La tecnologia di RV può essere immersiva o non immersiva, in funzione di quanto l’individuo sia isolato dall’ambiente fisico circostante (Chirico et al., 2016; Comparcini et al., 2023). La RV immersiva richiede: (a) un hardware come un PC, un tablet o un cellulare; (b) un software di giochi o animazioni in 3D; (c) un display montato sulla testa che impedisca la visione dell’ambiente circostante, in grado di fornire immagini ad alta risoluzione e dotato di visione stereoscopica e rilevatore di posizione; (d) un paio di cuffie che insonorizzino dai rumori esterni ma consentano in modalità stereo ad alta definizione l’ascolto dei suoni provenienti dall’ambiente virtuale con cui l’individuo interagisce (a volte il display e le cuffie sono dispositivi integrati in un casco con visore); (e) un set di guanti cablati o altri controller per il tracciamento del movimento (Chirico et al., 2016). Al contrario, la RV non immersiva implementa la scena virtuale utilizzando dispositivi con grafica tradizionale come un grande display o uno schermo a parete; sebbene sia connesso al mondo virtuale, l’individuo è in grado di recepire gli input visivi e uditivi dell’ambiente esterno e di comunicare con esso. Inoltre, le opzioni di interazione con l’ambiente virtuale sono limitate all’uso della tastiera o del mouse; infine, la RV non immersiva non fornisce alcuna sensazione di presenza (Chirico et al., 2016; Gupta et al., 2018; Ricci et al., 2022).
La RV è in grado di gestire il dolore e l’ansia attraverso il principio della distrazione: fornendo input percettivi come immagini, suoni, stimoli di feedback tattili e olfattivi (Althumairi et al., 2021; Lambert et al., 2020), sposta l’attenzione dell’individuo dal mondo reale a quello virtuale creando un senso di completa immersione (Meyerbroker et al., 2021). In questo modo, si interrompe la consapevolezza e la sensibilità ai fattori di stress e si ricolloca l’attenzione, la concentrazione e l’input emotivo reindirizzando i segnali neurali e spostando gli stimoli dannosi verso eventi neutri o piacevoli (Kothgassner et al., 2021).
La natura interattiva e avvincente della RV è considerata una tecnica di distrazione accattivante e coinvolgente nonché particolarmente efficace in ambito pediatrico quando viene incluso l’elemento del gioco per meglio catturare l’attenzione del bambino (Comparcini et al., 2023; Lambert et al., 2020).
In letteratura sono presenti tre revisioni sistematiche con meta-analisi che analizzano l’effetto della RV sulla sintomatologia e le emozioni dei bambini durante il trattamento antineoplastico (Cheng et al., 2022; Czech et al., 2023; Ozturk et al., 2023). Tuttavia, queste revisioni esaminano l’effetto dell’intervento a prescindere dal grado di immersione; inoltre, solo una (Cheng et al., 2022) analizza l’effetto dell’intervento sia sul dolore che sull’ansia e la paura. Infine, a partire dalla revisione che ha eseguito l’aggiornamento più recente (Ozturk et al., 2023) risalente a maggio 2023, sono stati pubblicati altri studi che valutano gli effetti della RV immersiva nei bambini affetti da neoplasia (Amali et al., 2023; Caballero et al., 2024; Gerceker et al., 2024; Kanad et al., 2024; Savas et al., 2024; Wong et al., 2022). Di conseguenza, manca una revisione sistematica con meta-analisi aggiornata e specificamente orientata all’effetto della RV immersiva sul dolore, l’ansia e la paura di questi bambini.
OBIETTIVI
Misurare l’effetto della realtà virtuale immersiva sul dolore, l’ansia e la paura dei bambini con neoplasia sottoposti a procedure mediche.
MATERIALI E METODI
Per raggiungere l’obiettivo è stata effettuata una revisione sistematica con meta-analisi condotta e presentata in aderenza al Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA) Statement (Page et al., 2021).
Criteri di inclusione
Per l’inclusione degli studi si sono considerati i seguenti criteri: (a) partecipanti: soggetti di età 0-18 anni con neoplasia diagnosticata di qualsiasi tipo e sottoposti a procedure mediche in qualsiasi setting di cura; (b) intervento: realtà virtuale immersiva; (c) controllo: cure standard o minimo intervento (es. giochi su tablet); (d) esiti (valutati con qualsiasi tipo di strumento): dolore, ansia, paura riferiti dal bambino a fine procedura; (e) disegno di studio: studi clinici randomizzati o quasi randomizzati (in questi ultimi l’assegnazione al gruppo di intervento o di controllo non è del tutto casuale – es. data di nascita, iniziali del cognome, ecc.) controllati a gruppi paralleli.
Strategie di ricerca
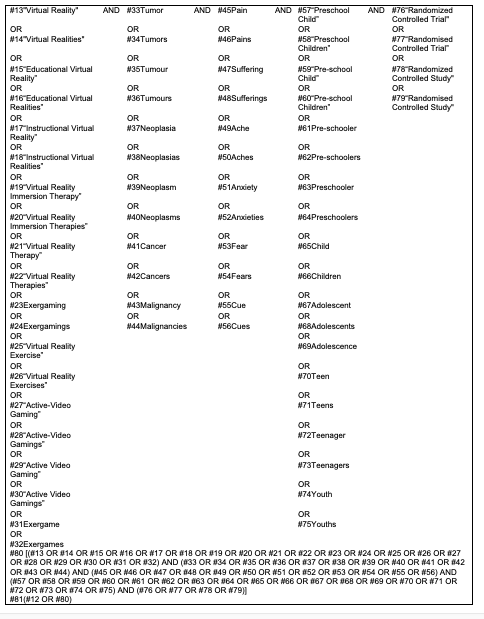
Il protocollo di revisione è stato registrato sulla piattaforma Open Science Framework (https://osf.io/24xa3/). La ricerca dei documenti è stata eseguita il 26 e 27 agosto 2024. Sono stati interrogati i database biomedici The Cochrane Library, MEDLINE (tramite PubMed), EMBASE (tramite Elsevier), CINAHL (tramite EBSCOhost), PsycINFO (tramite Ovid), Web of Science (tramite Clarivate Analytics) e Scopus (tramite Elsevier). Sono state utilizzate le seguenti parole chiave con i loro sinonimi: “realtà virtuale”, “dolore”, “ansia”e “paura”. Sono stati inoltre consultati i seguenti registri di trial: ClinicalTrials.gov, EU Clinical Trials. ICTRP e ISRCTN. Sono stati analizzati i riferimenti sia degli studi eleggibili che delle revisioni sistematiche pertinenti per argomento. Non sono stati imposti limiti di lingua o data di pubblicazione. La strategia di ricerca utilizzata per MEDLINE è mostrata in Tabella 1.
Selezione degli studi ed estrazione dei dati
Due autori (LGR e MD) in modo indipendente hanno selezionato i record dopo la lettura del titolo e, nei casi dubbi, anche dell’abstract. Dai record considerati pertinenti sono stati recuperati i relativi full text e, sempre in modo indipendente, due autori (LGR e MD) li hanno analizzati e valutati. Gli eventuali disaccordi sono stati superati con il confronto e la discussione.
Due autori (LGR e MD) in modo indipendente e utilizzando un modello condiviso e standardizzato hanno estratto dagli studi inclusi i seguenti dati: primo autore, anno di pubblicazione e Paese; disegno di studio; setting; procedura effettuata; caratteristiche del campione (numerosità totale e per gruppo, età media, percentuale di maschi, diagnosi prevalente, durata media di malattia); criteri di inclusione ed esclusione; caratteristiche dell’intervento e del controllo; outcome e relativi strumenti di valutazione; note; conflitti di interesse e fonti di finanziamento.
Rischio di bias
In modo indipendente due autori (SM e CR) hanno valutato il rischio di bias con il Revised Cochrane risk of bias tool for randomized trials (RoB 2) (Sterne et al., 2019). Qualsiasi disaccordo è stato risolto tramite confronto e discussione; se persisteva una differenza di opinione, è stato richiesto il parere dirimente di un altro autore (LGR). RoB 2 è uno strumento che esamina la validità interna di studi clinici randomizzati controllati ed è strutturato in domini attraverso cui potrebbero essere introdotti degli errori sistematici, o bias. I domini assumono il nome dalla fase di studio in cui sono riscontrabili i bias: (1) nel processo di randomizzazione; (2) per una deviazione dall’intervento programmato; (3) per dati mancanti; (4) nella misurazione degli esiti; (5) nella selezione dei risultati riportati. L’accertamento del rischio di bias viene effettuato con domande di segnalazione all’interno di algoritmi decisionali; in base alle risposte fornite, è possibile ottenere per ogni bias uno dei seguenti giudizi: (a) basso rischio; (b) alcune preoccupazioni; (c) alto rischio.
Tabella 1 – La strategia di ricerca.
Analisi e sintesi dei dati
La stima dell’effetto medio complessivo dell’intervento è stata calcolata tramite meta-analisi utilizzando un modello a effetti casuali nell’ipotesi di eterogeneità non trascurabile tra gli studi e producendo forest plots in presenza di almeno due studi per risultato. La differenza media standard (DMS) per le misure continue è stata calcolata con la d di Cohen: in funzione di valori d di 0.2, 0.5 o 0.8 (Cohen, 2013) la dimensione di effetto è stata assunta rispettivamente come piccola, moderata o grande. Nel caso di esiti misurati con lo stesso strumento di valutazione, è stata calcolata la differenza media non standardizzata (DMNS). Per il calcolo della deviazione dalla stima puntuale dell’effetto per ogni singolo studio e dalla stima complessiva per gli studi aggregati, è stato considerato un intervallo di confidenza (IC) pari al 95%. Con il test di Cochran Q (Cochran, 1950) è stata valutata la presenza di eterogeneità tra gli studi; il livello di eterogeneità è stato calcolato con l’indice di Higgins I2 (Higgins et al., 2003). Un livello basso, moderato, alto o molto alto di eterogeneità è stato assegnato rispettivamente a valori di I2 ≤ 30%, 30-60%, 60-90% o > 90% (Calderòn et al., 2011). L’elaborazione dei dati è stata eseguita con il software ProMeta© versione 3.0.
Analisi di sensibilità
L’analisi di sensibilità è stata eseguita rigenerando la meta-analisi dopo l’esclusione di eventuali trial quasi randomizzati.
Bias di pubblicazione
È stato ispezionato il funnel plot (Sterne et al., 2001) ed implementato il metodo Trim and Fill (Duval et al., 2000) per valutare il rischio di bias in caso di almeno cinque studi inclusi. Con il test di Egger (Egger et al., 1997), il test di Begg e Mazumdar (Begg et al., 1994) e il test Failsafe N (Orwin, 1983) è stata eseguita anche una valutazione oggettiva.
Riepilogo dei risultati
La valutazione complessiva della certezza/qualità delle prove è stata effettuata con una tabella di riepilogo dei risultati in ottemperanza al metodo GRADE (Balshem et al., 2011) in modo indipendente dagli autori (MD, SM e CR). Il confronto e la discussione hanno guidato la gestione di eventuali disaccordi; tuttavia, in caso di persistenza di opinioni contrastanti, è stato richiesto l’arbitrato dell’altro autore (LGR).
RISULTATI
Selezione degli studi
Dopo il ricorso alle fonti informative, sono stati reperiti 186 record; in Figura 1 è illustrato il flusso di selezione dei record.

Figura 1 – Processo di screening dei record.
Al termine del processo di screening, sono stati inclusi nella revisione sistematica 11 studi (Amali et al., 2023; Caballero et al., 2024; Gerceker et al., 2021; Gerceker et al., 2024; Hundert et al., 2022; Kanad et al., 2024; Savas et al., 2024; Semerci et al., 2021; Tennant et al., 2020; Wong et al., 2021; Wong et al., 2022) a cui sono corrisposti altrettanti report. Nessun altro studio che rispettasse i criteri di inclusione è stato intercettato attraverso l’analisi dei riferimenti degli studi eleggibili o delle revisioni sistematiche pertinenti all’argomento.
In Tabella 2 sono illustrate le caratteristiche principali degli studi inclusi.
Tabella 2 – Caratteristiche principali degli studi inclusi
Caratteristiche degli studi inclusi
Gli studi sono stati pubblicati tra il 2020 e il 2024; cinque sono stati condotti in Turchia (Gerceker et al., 2021; Gerceker et al., 2024; Kanad et al., 2024; Savas et al., 2024; Semerci et al., 2021), due in Cina (Wong et al., 2021; Wong et al., 2022), uno in India (Amali et al., 2023), uno in Spagna (Caballero et al., 2024), uno in Canada (Hundert et al., 2022) e uno in Australia (Tennant et al., 2020).
Tutti gli studi sono trial randomizzati controllati a gruppi paralleli tranne uno (Amali et al., 2023), che è un trial quasi randomizzato. In uno studio (Hundert et al., 2022) l’intervento è stato effettuato in ambulatorio, in tutti gli altri la sperimentazione è stata eseguita in ospedale.
Cinque studi (Caballero et al., 2024; Gerceker et al., 2021; Hundert et al., 2022; Savas et al., 2024; Semerci et al., 2021) hanno misurato l’effetto della RV durante l’accesso con ago di Huber al port-a-cath, tre studi (Amali et al., 2023; Wong et al., 2021; Wong et al., 2022) durante l’incannulamento endovenoso, uno durante il prelievo ematico (Kanad et al., 2024), uno durante la chemioterapia (Gerceker et al., 2024) e uno durante procedure diagnostiche o terapeutiche non meglio precisate (Tennant et al., 2020).
Gli studi hanno incluso complessivamente 742 bambini (47.8% maschi) con un’età media di 10.5 anni, diagnosi prevalente di leucemia, durata media di malattia compresa tra 7.5 e 20.7 mesi. La dimensione del campione varia da 19 (Wong et al., 2022) a 120 (Caballero et al., 2024) bambini. I criteri di esclusione più frequenti sono stati la presenza di disturbi cognitivi, visivi o uditivi o di importanti patologie psichiatriche oppure l’essere sottoposti a cure palliative o il trovarsi nella fase terminale di malattia.
L’ambiente di gioco in RV immersiva proposto più spesso ai bambini è stato Roller Coaster (Amali et al., 2023; Gerceker et al., 2024; Kanad et al., 2024; Semerci et al., 2021); la durata dell’intervento è stata variabile, da pochi minuti fino a quattro ore (Wong et al., 2022).
I bambini del gruppo sperimentale hanno ricevuto sia l’intervento che le cure standard.
I bambini del gruppo di controllo in due casi (Hundert et al., 2022; Tennant et al., 2020) hanno ricevuto insieme alle cure standard una distrazione minima (gioco su tablet). In due studi (Caballero et al., 2024; Hundert et al., 2022) sia al gruppo di intervento che a quello di controllo è stato somministrato un anestetico topico.
Nove studi hanno valutato il dolore percepito dal bambino; cinque di essi (Amali et al., 2023; Gerceker et al., 2021; Kanad et al., 2024; Savas et al., 2024; Semerci et al., 2021) hanno utilizzato come strumento di misura la Wong–Baker Faces Pain Rating Scale (Wong et al., 1988), due (Tennant et al., 2020; Wong et al., 2021) la Visual Analogue Scale (Langley et al., 1985), uno (Caballero et al., 2024) la Faces Pain Scale-Revised (Hicks et al., 2001) e uno (Hundert et al., 2022) la Numerical Rating Scale (Jensen et al. 2001).
Sette studi (Caballero et al., 2024; Gerceker et al., 2021; Gerceker et al., 2024; Savas et al., 2024; Tennant et al., 2020; Wong et al., 2021; Wong et al., 2022) hanno misurato l’ansia percepita dal bambino; cinque di essi (Caballero et al., 2024; Gerceker et al., 2024; Savas et al., 2024; Wong et al., 2021; Wong et al., 2022) hanno utilizzato lo State-Trait Anxiety Inventory for Children (Spielberger, 1973), uno (Gerceker 2021) il Children’s Anxiety Meter-State (Ersig et al., 2013) e uno (Tennant et al., 2020) la Visual Analogue Scale.
Infine, tutti e cinque gli studi che hanno misurato la paura percepita dal bambino (Amali et al., 2023; Gerceker et al., 2021; Hundert et al., 2022; Kanad et al., 2024; Savas et al., 2024) hanno utilizzato la Children’s Fear Scale (McMurtry et al., 2011). Altri esiti riferiti al bambino valutati dagli studi inclusi hanno riguardato gli stati emotivi (dolore catastrofizzante, angoscia, rabbia, tono dell’umore, comportamento emotivo), i sintomi (fatigue, nausea, vomito), i parametri fisiologici (frequenza respiratoria, frequenza cardiaca, pressione arteriosa), l’accettabilità, la soddisfazione e il livello di immersività.
Sei studi (Caballero et al., 2024; Hundert et al., 2022; Savas et al., 2024; Tennant et al., 2020; Wong et al., 2021; Wong et al., 2022) hanno ricevuto una qualche forma di finanziamento o donazione, mentre nessuno degli autori degli studi inclusi ha riferito di avere conflitti di interesse.
Rischio di bias
La Figura 2 illustra il rischio di bias degli studi inclusi con lo strumento Risk of Bias 2. Nel complesso, il rischio di bias è alto per quattro studi (Amali et al., 2023; Caballero et al., 2024; Semerci et al., 2021; Tennant et al., 2020), desta alcune preoccupazioni per altri quattro (Gerceker et al., 2021; Gerceker et al., 2024; Kanad et al., 2024; Wong et al., 2022) ed è basso per tre (Hundert et al., 2022; Savas et al., 2024; Wong et al., 2021).
Dolore: RV vs. cure standard
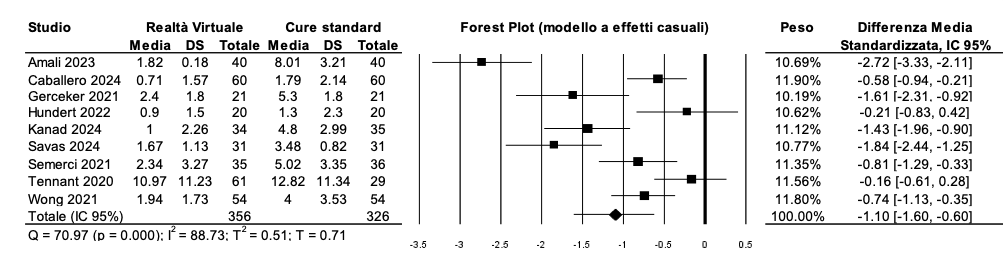
L’effetto della RV a confronto con le cure standard sul dolore percepito dal bambino è stato valutato su 682 partecipanti. La differenza media standardizzata è pari a DMS = -1.10 (95% CI: -1.60, -0.60) a favore dell’intervento; il risultato è statisticamente significativo (Tabella 3). L’eterogeneità statistica è significativa (Q = 70.97, p = 0.000) ed elevata (I2 = 88.73%).
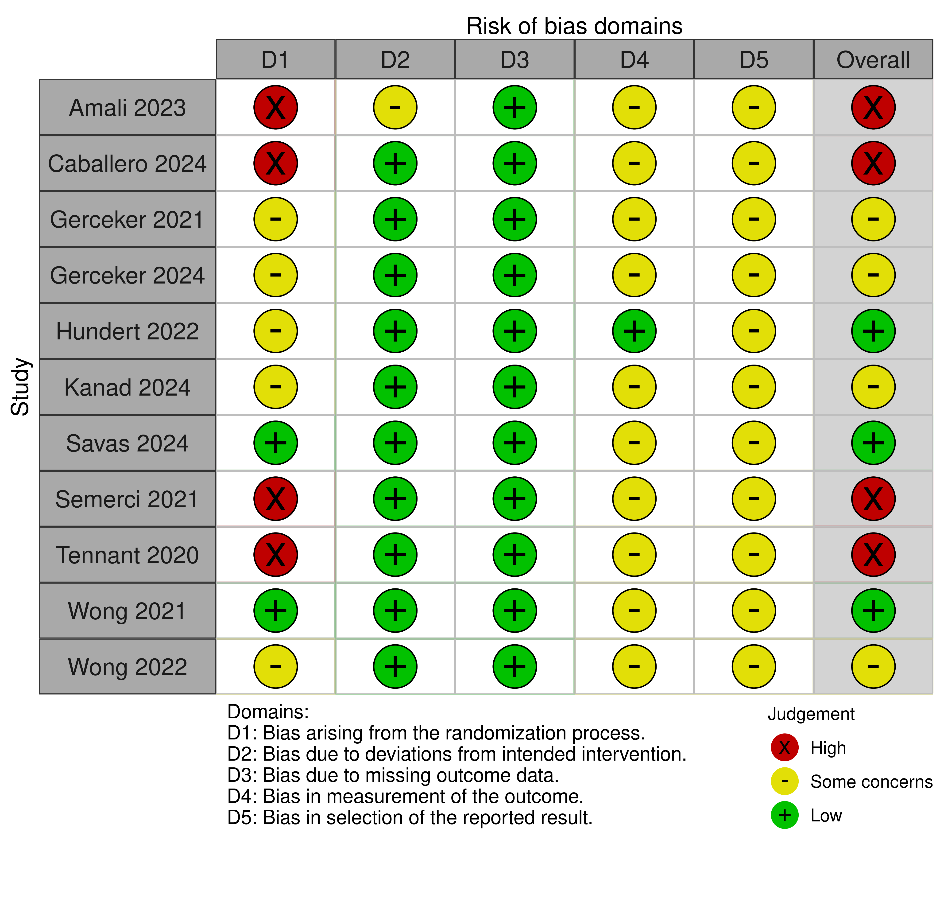
Figura 2 – Risk of Bias 2.
Tabella 3 – Dolore: RV vs. cure standard.
Ansia: RV vs. cure standard
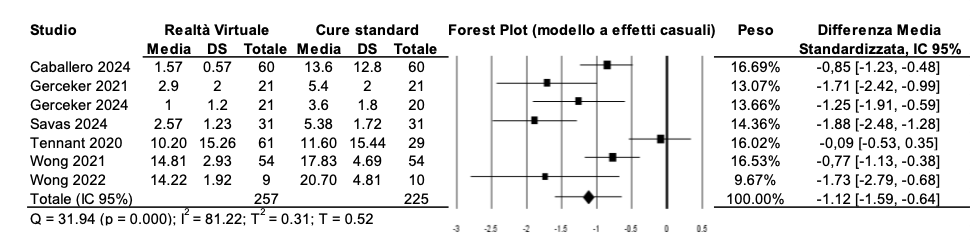
L’effetto della RV a confronto con le cure standard sull’ansia percepita dal bambino è stato valutato su 482 partecipanti. La differenza media standardizzata è pari a DMS = -1.12 (95% CI: -1.59, -0.64) a favore dell’intervento; il risultato è statisticamente significativo (Tabella 4). L’eterogeneità statistica è significativa (Q = 31.94, p = 0.000) ed elevata (I2 = 81.22%).
Tabella 4 – Ansia: RV vs. cure standard.
Paura: RV vs. cure standard
L’effetto della RV a confronto con le cure standard sulla paura percepita dal bambino è stato valutato su 290 partecipanti. La differenza media non standardizzata è pari a DMNS = -1.32 (95% CI: -1.82, -0.81) a favore dell’intervento; il risultato è statisticamente significativo (Tabella 5). L’eterogeneità statistica è significativa (Q = 19.68, p = 0.001) ed elevata (I2 = 79.68%).
Tabella 5 – Ansia: RV vs. cure standard.
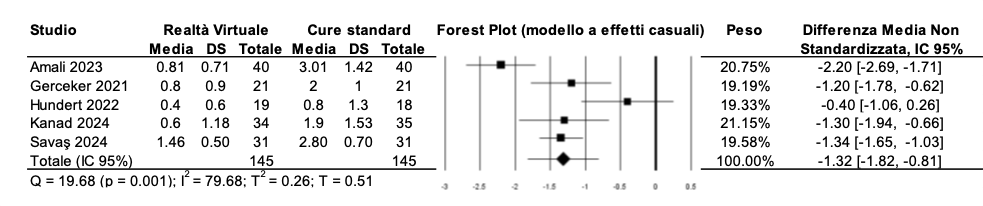
Analisi di sensibilità
Per valutare la robustezza dell’effetto complessivo dell’intervento sul dolore la meta-analisi è stata rigenerata dopo la rimozione dello studio quasi randomizzato (Amali et al., 2023). La differenza media standardizzata, calcolata su 602 partecipanti, è pari a DMS = -0.90 (95% CI: -1.29, -0.50) a favore dell’intervento; il risultato è statisticamente significativo. L’eterogeneità statistica è significativa (Q = 35.45, p = 0.000) ed elevata (I2 = 80.26%). Quanto ottenuto conferma la robustezza dell’effetto complessivo dell’intervento e la sua grande dimensione d’effetto.
Bias di pubblicazione
Il bias di pubblicazione è possibile ma sembra improbabile (Figura 3). Questa considerazione è il risultato dell’implementazione del metodo Trim and Fill, poiché nessuno studio è stato tagliato e le due dimensioni dell’effetto, quella stimata (in nero) e quella osservata (in bianco), coincidono; inoltre, né il test di Egger (p = 0.093) né il test di Begg e Mazumdar (p = 0.095) sono statisticamente significativi. Infine, il risultato del test FailSafe N (N = 331) supera ampiamente il valore soglia (5k + 10 = 55; k = studi inclusi nella meta-analisi).
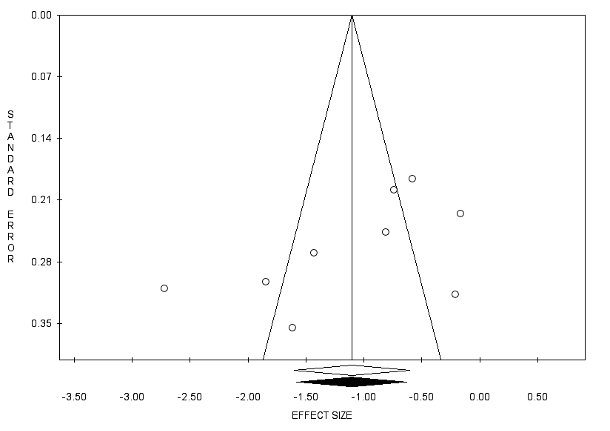
Figura 3 – Funnel plot.
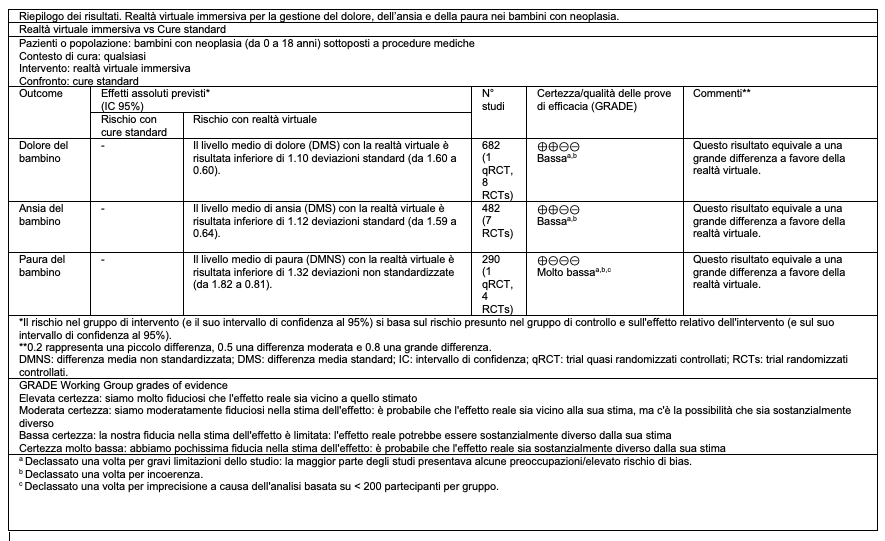
Riepilogo dei risultati
Per l’effetto della RV a confronto delle cure standard o minima distrazione sui bambini con neoplasia da sottoporre a procedure mediche il riepilogo dei risultati, effettuato in ottemperanza al metodo GRADE, ha prodotto una certezza/qualità delle prove bassa sul dolore e l’ansia e molto bassa sulla paura (Tabella 6).
Tabella 6 – Riepilogo dei risultati.
DISCUSSIONE
Risultati principali
L’obiettivo di questa revisione sistematica con meta-analisi è stato quello di misurare l’effetto della realtà virtuale immersiva sul dolore, l’ansia e la paura dei bambini con neoplasia sottoposti a procedure mediche. I risultati mostrano che l’intervento determina un ampio e statisticamente significativo beneficio su tutti e tre gli esiti rispetto alle cure standard o a una minima distrazione. L’analisi di sensibilità ha confermato l’ampia dimensione d’effetto e la significatività statistica. Ciò è coerente con i risultati delle revisioni sistematiche con meta-analisi precedenti: anch’esse hanno evidenziato l’efficacia dell’intervento sul dolore (Cheng et al., 2022; Czech et al., 2023; Ozturk et al., 2023), l’ansia (Cheng et al., 2022; Czech et al., 2023; Ozturk et al., 2023) e la paura (Cheng et al., 2022).
Oltre che ampio e statisticamente significativo, l’effetto della realtà virtuale immersiva è anche clinicamente rilevante. Infatti, convertendo (Lenhard et al., 2022) i valori di d di Cohen in valori di NNT (Number Needed to Treat = Numero di soggetti da trattare con l’intervento affinchè uno di essi ne tragga beneficio) si scopre che l’intervento è efficace nel controllare (a) il dolore in quattro bambini ogni sette trattati (NNT = 1.775), (b) l’ansia in quattro bambini ogni sette trattati (NNT = 1.749) e (c) la paura in quattro bambini ogni sei trattati (NNT = 1.540).
Tuttavia, la certezza/qualità delle prove per il dolore e l’ansia è bassa quindi la fiducia sulla stima dell’effetto è limitata: l’effetto reale potrebbe essere sostanzialmente diverso. Inoltre, la certezza/qualità delle prove per la paura è molto bassa quindi vi è pochissima fiducia sulla stima dell’effetto: è probabile che l’effetto reale sia sostanzialmente diverso.
Implicazioni per la pratica
La RV potrebbe aiutare a controllare il dolore, l’ansia e la paura di bambini sia di genere maschile che femminile e di età compresa tra gli 8 e i 12 anni circa durante le procedure correlate alla cura della neoplasia, come l’accesso al port-a-cath con ago di Huber, il prelievo o l’incannulamento endovenoso oppure la chemioterapia. Nonostante i risultati siano promettenti, allo stato attuale occorre prestare attenzione nel trarre conclusioni sul beneficio dell’intervento in quanto la fiducia sui risultati è limitata o molto limitata. Ciò deriva essenzialmente dalle ridotte dimensioni campionarie degli studi inclusi, dalla loro qualità metodologica (soltanto tre studi sono a basso rischio di bias) ed elevata eterogeneità (es. diversa procedura implementata; differente tipo, stadio e durata di malattia; utilizzo o meno di anestetico topico).
Idealmente, la RV dovrebbe catturare l’attenzione, essere altamente immersiva, semplice per i bambini più piccoli e divertente per quelli più grandi, eticamente e culturalmente sensibile e appropriata per il contesto di cura; il livello di immersione, coinvolgimento narrativo e interattività sembrerebbe aumentarne l’efficacia (Yap et al., 2020). Purtroppo, la disponibilità di giochi o scenari RV per la gestione di sintomi ed emozioni dei bambini con neoplasia è ancora limitata e questo può condizionare la ricerca di contenuti in grado di ottimizzare il beneficio dell’intervento (Nerini et al., 2024); dati i diversi stili di coping, si dovrebbe disporre di una più ampia scelta. Questo aspetto è importante, perchè (a) certi scenari potrebbero esporre i bambini a esperienze troppo intense o spaventose in grado ad esempio di aumentarne l’ansia, anziché ridurla (Mahrer et al., 2009); (b) alcuni bambini preferiscono scenari e musiche rilassanti mentre altri apprezzano giochi emozionanti e affascinanti (Nerini et al., 2024). In termini di risposta all’intervento non è da sottovalutare il ruolo di due variabili agenti da moderatori o modificatori di effetto quali il livello di esperienza nei confronti di giochi o scenari di RV e l’abitudine a procedure invasive per il trattamento della neoplasia. Un problema a livello di hardware, presumibilmente risolvibile con i prossimi avanzamenti tecnologici, è rappresentato dal fatto che le attuali apparecchiature per la RV pongono limiti all’età dei bambini che ne potrebbero usufruire, perché per quelli più piccoli i visori/display e/o le cuffie sono dispositivi troppo pesanti o grandi da indossare (Lambert et al., 2020). In funzione del tipo di procedure la configurazione dell’apparecchiatura di RV dovrebbe cambiare: se di breve durata come prelievi o incannulamenti endovenosi, sistemi di RV che richiedono solo movimenti della testa garantirebbero la sicurezza del bambino; se più lunghe come la chemioterapia, tecnologie più complesse che prevedano l’utilizzo di un controller portatile associato a un visore potrebbero essere un’opzione. Naturalmente la RV non può e non deve sostituire l’interazione umana e il supporto emotivo da parte della famiglia e degli operatori sanitari di cui i bambini con neoplasia hanno bisogno; inoltre, questa tipologia di intervento può integrare ma non sostituirsi ai tradizionali approcci di cura (Nerini et al., 2024).
Uno dei potenziali effetti collaterali della RV, specie durante un uso prolungato (Wu et al., 2023), è la cinetosi, che può causare nausea e vertigini (Gold et al., 2018) e portare ad affaticamento degli occhi e cefalea (Li et al., 2011). Come conseguenza, alcuni autori (Aubrey et al., 2018) consigliano quale limite di tempo massimo di utilizzo della RV 5-10 minuti. Tuttavia, sembra che un alto grado di immersione del contenuto di RV, una ridotta animazione virtuale e scene virtuali in movimento possano ridurre i sintomi della cinetosi (Veličković et al., 2021).
Implicazione per la ricerca
Occorrono studi di migliore qualità metodologica e multicentrici per avere un’ampia dimensione campionaria; questo a vantaggio di una maggiore potenza statistica e della fattibilità di un’analisi per sottogruppi da organizzare in funzione dei principali moderatori di effetto dell’intervento come genere, fascia di età, procedura, tipo di neoplasia, durata media di malattia. È necessario provvedere ad una maggiore standardizzazione della metodologia di ricerca degli studi a partire dall’utilizzo, a parità di esito, dello stesso strumento di valutazione, poiché ciò potrebbe contribuire a fornire indicazioni più specifiche sull’efficacia della RV. Le ricerche future dovranno esplorare l’influenza di fattori come la frequenza, la durata, i cicli ottimali dell’intervento e includere i suoi effetti a lungo termine per determinare se possa svolgere un ruolo efficace come strumento di supporto nella cura della malattia. Dovrebbe essere considerato, anche attraverso la creazione di team comprendenti bambini, infermieri, oncologi, psicologi e programmatori (Burrai et al., 2023), lo sviluppo di giochi di RV appositamente progettati per migliorare il coinvolgimento e soddisfare le esigenze e gli interessi specifici di questa speciale popolazione di pazienti; a questo proposito, ulteriori studi dovrebbero valutare tempi e modalità del loro recupero psicofisico in funzione dei diversi scenari di RV. L’utilizzo di visori più leggeri e comodi o di dispositivi alternativi come gli smartphone dovrebbe essere esplorato per superare i limiti fisici della tecnologia RV e consentire anche ai bambini più piccoli di poter usufruire dell’intervento.
La sicurezza in merito ai possibili effetti avversi della tecnologia RV, come ad esempio la cinetosi, è una variabile importante da indagare dalle prossime ricerche. Per misurare la cinetosi sarebbe consigliabile utilizzare strumenti di valutazione convalidati, come il Virtual Reality Symptom Questionnaire (Ames et al., 2005). Infine, è auspicabile che gli studi futuri confrontino la RV con altri metodi di distrazione consolidati per determinare se l’intervento sia davvero efficace ed economicamente vantaggioso.
Limiti
Tranne in un caso (Amali et al., 2023), gli studi inclusi sono monocentrici e con piccole dimensioni campionarie, il che limita la generalizzabilità dei risultati. Per la natura stessa dell’intervento, non si può garantire il doppio cieco; tuttavia, l’accecamento dei valutatori dei risultati è possibile (Hundert et al., 2022) e necessario, al fine di assicurare una valutazione imparziale dei risultati. L’occultamento dell’assegnazione dell’intervento e il mascheramento benchè impegnativi sono fattibili, come dimostrato da due studi (Savas et al., 2024; Wong et al., 2021).
I partecipanti degli studi sono stati eterogenei in termini di procedure e di tipo, grado e durata media di malattia; inoltre, hanno usufruito per un tempo molto variabile di giochi o scenari RV diversi tramite piattaforme hardware con caratteristiche differenti. Sia ai gruppi di intervento che a quelli di controllo sono state garantite cure standard che tuttavia non sono state definite in dettaglio: ad esempio, il livello di coinvolgimento dei genitori non è stato precisato e, in caso di utilizzo per via topica di terapia anestetica (Caballero et al., 2024; Hundert et al., 2022), di essa non sono stati resi noti i tempi, le modalità di somministrazione e le dosi. Di più, in due studi (Hundert et al., 2022; Tennant et al., 2020) il gruppo di controllo ha ricevuto una distrazione minima insieme alle cure standard.
Infine, occorre menzionare due limiti relativi alla sicurezza dell’intervento: (a) di rado gli studi hanno valutato l’effetto della cinetosi o dei sintomi correlati all’uso prolungato della RV; (b) nessuno studio ha fornito dettagli sulle strategie implementate per igienizzare l’attrezzatura per la RV, aspetto questo molto importante avendo a che fare con soggetti a vario grado immunocompromessi.
CONCLUSIONI
Nei bambini con neoplasia l’effetto della realtà virtuale sul dolore, l’ansia e la paura a confronto con cure standard o minima distrazione è ampio e statisticamente significativo; tuttavia, il livello di certezza/qualità delle prove è basso o molto basso. Fino a quando le future ricerche non forniranno un ulteriore supporto ai risultati, questi al momento possono solo contribuire a dare un’indicazione sul beneficio dell’intervento per alcune procedure mediche implementate per curare la malattia.
Conflitto di interessi
Gli autori dichiarano l’assenza di conflitto di interessi.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e l’assenza di sponsor economici.
Contributi degli autori
Tutti gli autori hanno contribuito all’ideazione e alla conduzione dello studio, alla stesura dell’articolo, alla sua revisione critica e alla conseguente approvazione della versione finale dello stesso.
Registrazione dello studio
Open Science Framework (https://osf.io/24xa3/).





