RIASSUNTO
Introduzione Le prove sulla mobilità precoce, a tre ore (3h) dall’impianto di pacemaker (PM), sono ancora esigue e con risultati poco significativi in termini di sicurezza. Lo studio ha l’obiettivo di confrontare gli effetti di una mobilizzazione precoce (3h) dopo l’impianto di PM, rispetto a una mobilizzazione tardiva (24h), in termini di sicurezza.
Materiali e metodi Studio sperimentale che ha selezionato i pazienti ricoverati per impianto elettivo di PM presso il Centro Cardiologico Monzino di Milano da settembre fino a dicembre 2014. I soggetti sono stati suddivisi in due gruppi: gruppo 3h con mobilità dopo 3h dall’impianto, gruppo 24h con mobilità dopo 24h dall’impianto. Entro il termine del ricovero sono stati valutati come esiti di sicurezza: le complicanze post operatorie, il dolore lombare (DL) e il dolore alla tasca (DT).
Risultati Sono stati presi in esame 30 pazienti (15 vs 15). L’incidenza di ematoma minore era più alta dopo mobilità tardiva ma senza significatività statistica (gruppo 24h: n=4 vs gruppo 3h: n=3; p=1). Non sono stati descritti casi di dislocazione in entrambi i gruppi. Il gruppo 3h ha riferito livelli di DL e DT minori rispetto al gruppo 24h (p<0,05). Nessun soggetto del gruppo 3h ha assunto analgesici per DL, mentre il 33,3% del gruppo 24h (p=0,042) ha assunto analgesici per DL. Il 46,7% dei soggetti di entrambi i gruppi (p=1) ha assunto farmaci per DT. L’indicazione di eparine a basso peso molecolare il giorno dell’impianto, l’età avanzata e il genere femminile si associavano a esiti negativi in termini di sicurezza.
Conclusioni La mobilizzazione precoce a tre ore dall’impianto di PM sembrerebbe avere un impatto positivo su alcuni esiti. Tuttavia, l’efficacia è stata rilevata solo in una parte degli esiti esaminati. Sono necessari studi ulteriori con alcuni cambiamenti nel metodo.
Parole chiave: mobilità, pacemaker, sicurezza, complicanze post operatorie, dolore
Three hours mobility after a pacemaker implant: study of the effects on patients’ safety during the hospitalization
ABSTRACT
Background Evidences on the effects of early mobilization, three hours (3h) after the pacemaker (PM) implant, are still scarce with not significant outcomes on patient safety. This study aims to verify the effects of early mobilization (3h), after PM implant, on safety of patients compared to prolonged bed rest (24h).
Methods Experimental study that selected patients admitted at the Centro Cardiologico Monzino in Milan for an elective PM implant from September to December 2014. The subjects were randomized into two groups: 3h group with a mobility after 3h, 24h group with a mobility after 24h. Up to the end of hospitalization assessed safety outcomes were: postoperative complications or back pain (BP) and pocket PM pain (PP).
Results 30 patients were included (15 vs 15). The incidence of minor hematoma was higher after a prolonged bed rest but without statistical significance (24h group: n=4 vs 3h group: n=3; p=1). No cases of dislocation were reported in both groups. Less levels of BP and PP were reported in group 3h compared to 24h group (p<0.05). No subject of the 3h group took analgesics for BP, vs 33.3% of 24h group (p=0.042). 46.7% of subjects of both group took drugs for PP (p=1). The indication to low molecular weight heparin in the day of implant, old age and female gender were related with negative safety outcomes.
Conclusions A positive effect on certain outcomes would seem to be associated with an early mobilization three hours after a PM implant. Nevertheless, only some differences in safety outcomes were statistically significant. Further experimental studies are strictly required with different methodology.
Keywords: mobility, artificial pacemaker, patient safety, postoperative complications, pain
![]()
INTRODUZIONE
Gli interventi per l’impianto di un dispositivo cardiaco sono in continua crescita (Brignole et al., 2013). In particolare, l’Associazione italiana di aritmologia e cardiostimolazione ha censito 19.480 nuovi impianti di pacemaker (PM) realizzati nel 2014 sul territorio italiano (Proclemer et al., 2016). La frequenza di complicanze dopo questo intervento va dal 2,5% all’8,9% a seconda degli studi (Shakya et al., 2017; Kirkfeldt et al., 2014) e la manifestazione di tali eventi negativi, nel periodo post operatorio, viene associata all’aumento dei costi sanitari (Tobin et al., 2000).
La letteratura (Miracapillo et al., 2006; Simonelli et al., 2012, 2014) ha descritto una riduzione complessiva delle complicanze post operatorie, secondarie all’impianto di PM, per i pazienti mobilizzati precocemente dopo l’intervento rispetto a quelli che sono rimasti a letto per un tempo più prolungato.
Tuttavia le prove (Miracapillo et al., 2006; Simonelli et al., 2012) riguardanti la mobilità precoce (3h dall’impianto) e il rischio di complicanze sono ancora esigue e discordanti.
Miracapillo et al. (2006) ha descritto una frequenza dell’ematoma alla tasca sottocutanea del PM simile in pazienti che hanno seguito diversi protocolli di mobilità (3h vs 24h); il medesimo studio ha registrato un minor numero di casi di dislocazione degli elettrocateteri del PM (2/57 vs 3/77) per il gruppo a mobilità precoce (3h) rispetto ai soggetti con periodo protratto di riposo (24h) senza alcuna significatività statistica.
Un’altra indagine (Simonelli et al., 2012) ha rilevato un maggior numero di casi di emorragia della tasca (2/16 vs 1/16) per i pazienti che si sono alzati dopo tre ore dall’intervento, rispetto a quelli che si si sono alzati dopo 36 ore (non significativo), mentre il numero di dislocazioni era uguale nei due gruppi (0 vs 0).
Diversi studi (Birnie et al., 2013; Chow et al., 2010; De Sensi et al., 2015; Simonelli et al., 2014; Van Eck et al., 2007) hanno trovato un aumento del rischio di complicanze dopo impianto nei soggetti con indicazione alla terapia anticoagulante oppure con un ridotto indice di massa corporea (BMI).
Una ricerca caso-controllo (Simonelli et al., 2014) ha confrontato il rischio di complicanze dopo mobilizzazione precoce (24h) e tardiva (48h). Dall’analisi dei 411 pazienti aritmici sembra che la riduzione del tempo di riposo a letto sia associata a un minor rischio di complicanze intraospedaliere (ematoma della tasca, gruppo 48h: 3,2% vs gruppo 24h: 1,9%, odds ratio: 1,71, p=0,4269; dislocazione degli elettrocateteri, gruppo 48h: 1,9% vs gruppo 24h: 0,6%, odds ratio: 3,23, p=0,2863) tutte differenze che non raggiungono però la significatività statistica. Inoltre i soggetti del gruppo 24h hanno registrato un minore uso di farmaci analgesici per dolore lombare (DL) o alla tasca (DT) dopo l’impianto (DL, gruppo 48h: 12% vs gruppo 24h, 3,1%, odds ratio: 4,21, p=0,0036; DT, gruppo 48h: 13,1% vs gruppo 24h: 3,7%, odds ratio: 3,88, p=0,0029). Nei soggetti indagati il BMI ridotto si è rivelato come un predittore indipendente di DL (odds ratio: 0,78, IC 95% da: 0,65 a 0,94, p=0,009); mancano dati sulla relazione tra i casi di dolore e altre caratteristiche dei pazienti (sesso, età). Le conclusioni hanno sottolineato come il dolore post impianto sia un elemento di notevole importanza nell’assistenza (circa il 9% dei soggetti coinvolti si è avvalso delle terapie analgesiche) e sia un argomento meritevole di ulteriori approfondimenti scientifici.
Sono quindi necessarie ulteriori valutazioni sulla mobilizzazione precoce considerando anche il livello di dolore dei pazienti e gli altri esiti di sicurezza (quali l’ematoma della tasca, la dislocazione degli elettrocateteri e l’utilizzo di analgesici).
Il presente studio si propone l’obiettivo di verificare gli effetti di una mobilizzazione precoce (3h) dopo l’impianto di PM sulla sicurezza dei pazienti, rispetto a una mobilizzazione tardiva (24h).
MATERIALI E METODI
Disegno dello studio
Questa indagine è stata realizzata con un disegno sperimentale di tipologia pre post test con gruppo di controllo.
Popolazione e campione
La popolazione di riferimento sono i pazienti adulti ricoverati nelle Unità di cardiologia/aritmologia dell’I.R.C.C.S. Centro Cardiologico Monzino (CCM) di Milano.
Il campione è stato formato secondo il metodo di convenienza. Sono stati inclusi i pazienti con indicazione di primo impianto di PM mono o bicamerale, mentre sono stati esclusi i pazienti con compromissione patologica (per esempio Parkinson) dei movimenti del corpo.
Modalità di raccolta dei dati
Lo studio è stato condotto da settembre a dicembre 2014.
Dopo l’impianto, i pazienti sono stati assegnati ai due gruppi (sperimentale o controllo) tramite tecnica di randomizzazione semplice[1] compiuta dallo sperimentatore primario (SN). La preferenza di allocazione ai gruppi è stata comunicata ai sanitari dei reparti mediante una busta sigillata.
Sia i dati descrittivi dei pazienti (anagrafici e clinici) sia quelli relativi ai loro esiti (complicanze e dolore) sono stati interamente registrati dagli infermieri che sono rimasti esterni alla progettazione, ma che hanno assistito direttamente i soggetti durante il ricovero per l’impianto del PM.
Prima di iniziare lo studio tutti i professionisti sanitari (personale infermieristico e medico) dei reparti coinvolti hanno sostenuto una breve formazione (circa 30 minuti di lezione frontale) in merito ai comportamenti a loro richiesti per la corretta realizzazione di questa ricerca.
Definizione dei gruppi di studio
I pazienti reclutati sono stati tutti sottoposti a un intervento di impianto di PM in modalità elettiva, tramite anestesia locale e mediante accesso venoso cefalico o via succlavia.
Il gruppo di controllo ha seguito il protocollo di mobilizzazione standard: 24 ore di riposo a letto dopo l’intervento con mantenimento di una medicazione compressiva (Figura 1) al sito di impianto.
Figura 1 – Medicazione compressiva
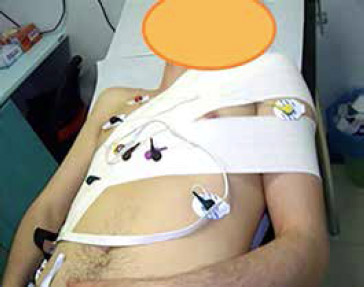
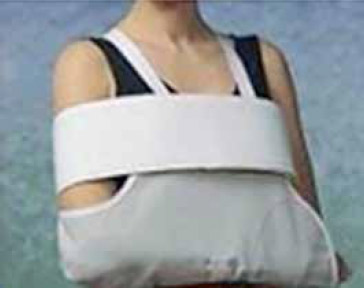
I pazienti del gruppo sperimentale hanno avuto la possibilità di muoversi dopo tre ore dall’impianto previa applicazione di un reggi braccio (Figura 2), posto al di sopra della medicazione compressiva standard. La scelta di questa metodica di trattamento dei pazienti sperimentali è stata uniforme a quella utilizzata in studi precedenti che hanno valutato l’efficacia della mobilità precoce sulla sicurezza dopo impianto di PM (Miracapillo et al., 2006; Simonelli et al., 2012).
Figura 2 – Reggi braccio posizionato sopra la medicazione compressiva (gruppo 3h)
Nei reparti coinvolti la prassi medica ha previsto una dimissione dalle cure ospedaliere dopo almeno 48 ore dall’impianto di PM salvo complicazioni.
Misure ed esiti
Sono state registrate le caratteristiche anagrafiche (sesso, età) e cliniche (BMI, durata del ricovero, anamnesi positiva per dolore cronico, indicazione e tipologia di PM impiantato, fissaggio endocardico PM, terapia anticoagulante e/o antiaggregante sostenuta il giorno dell’intervento, tipologia di sutura della tasca del PM, esperienza del team sanitario di impianto) dei pazienti inclusi.
Le complicanze (ematoma della tasca e dislocazione degli elettrocateteri) avvenute entro il termine del ricovero sono state rilevate con i seguenti indicatori di esito:
- ematoma della tasca del PM, qualsiasi rigonfiamento della tasca del PM con sospetto clinico di ematoma (Simonelli et al., 2014);
- dislocazione degli elettrocateteri del PM, rilevamento di difetti non correggibili dalla riprogrammazione del PM oppure evidenza di dislocazione alla radiografia del torace con o senza perforazione del tessuto pleurico o pericardico (Simonelli et al., 2014).
I casi emorragici sono stati classificati a seconda della gravità in:
- minore, dimensioni <5 cm che non necessita di intervento dei sanitari;
- moderato, dimensioni ≥5 cm che necessita di una nuova compressione o di un cambiamento del piano terapeutico;
- severo, dimensioni ≥5 cm che necessita di una trasfusione sanguigna o di un reintervento in sala operatoria.
I livelli di DL e DT sono stati accertati con la scala di valutazione numerica “Numerical Rating Scale” (NRS) all’ingresso in reparto, dopo 3, 6, 12 ore dall’impianto di PM e alla dimissione. La scala NRS è stata somministrata chiedendo a tutti i pazienti: “Su una scala da 0 a 10, dove 0 rappresenta l’assenza di dolore e 10 il peggior dolore possibile, qual è il suo livello di dolore?”. L’affidabilità e la validità di tale strumento per il monitoraggio dell’intensità del dolore è stata confermata da numerosi studi (Gagliese 2001; Gagliese et al., 2005; Ferreira-Valente et al., 2011). Sono stati documentati anche i casi di somministrazione analgesica per DL e/o DT.
Analisi statistica e dimensione campionaria
L’analisi dei dati è stata realizzata da statistici tramite software SASv 9.2 (SAS Institute Inc., Cary, NC, USA). Sono state utilizzate frequenze e percentuali per la descrizione delle variabili categoriche, le variabili continue sono state esposte come medie e deviazioni standard. Il test del chi quadro o il test esatto di Fisher sono stati adottati per confrontare le variabili categoriche tra i due gruppi mentre il test T di Student o test non parametrico di Wilcoxon per valutare le differenze nelle variabili continue.
Nei due gruppi, la differenza (delta o Δ) fra i livelli medi di DL e DT nei tempi di valutazione (ingresso, 3 ore, 6 ore, 12 ore, dimissione) è stata esaminata tramite analisi della covarianza ANCOVA aggiustando per le variabili confondenti (sesso, età e somministrazione di analgesici).
È stato considerato significativo un valore p inferiore al 5% (p<0,05).
Aspetti etici
Lo studio è stato svolto nel rispetto dei principi della dichiarazione di Helsinki (Rickham, 1964) assicurando la riservatezza dei dati personali dei pazienti ai quali è stato richiesto il consenso, per iscritto, come requisito per la partecipazione. Il protocollo di questo studio ha ottenuto il parere positivo del Comitato Scientifico ed Etico del Centro Cardiologico Monzino di Milano prima della realizzazione secondo le linee guida per la buona pratica clinica (International Conference on Harmonisation, 2017).
RISULTATI
Reclutamento e valutazione dei partecipanti
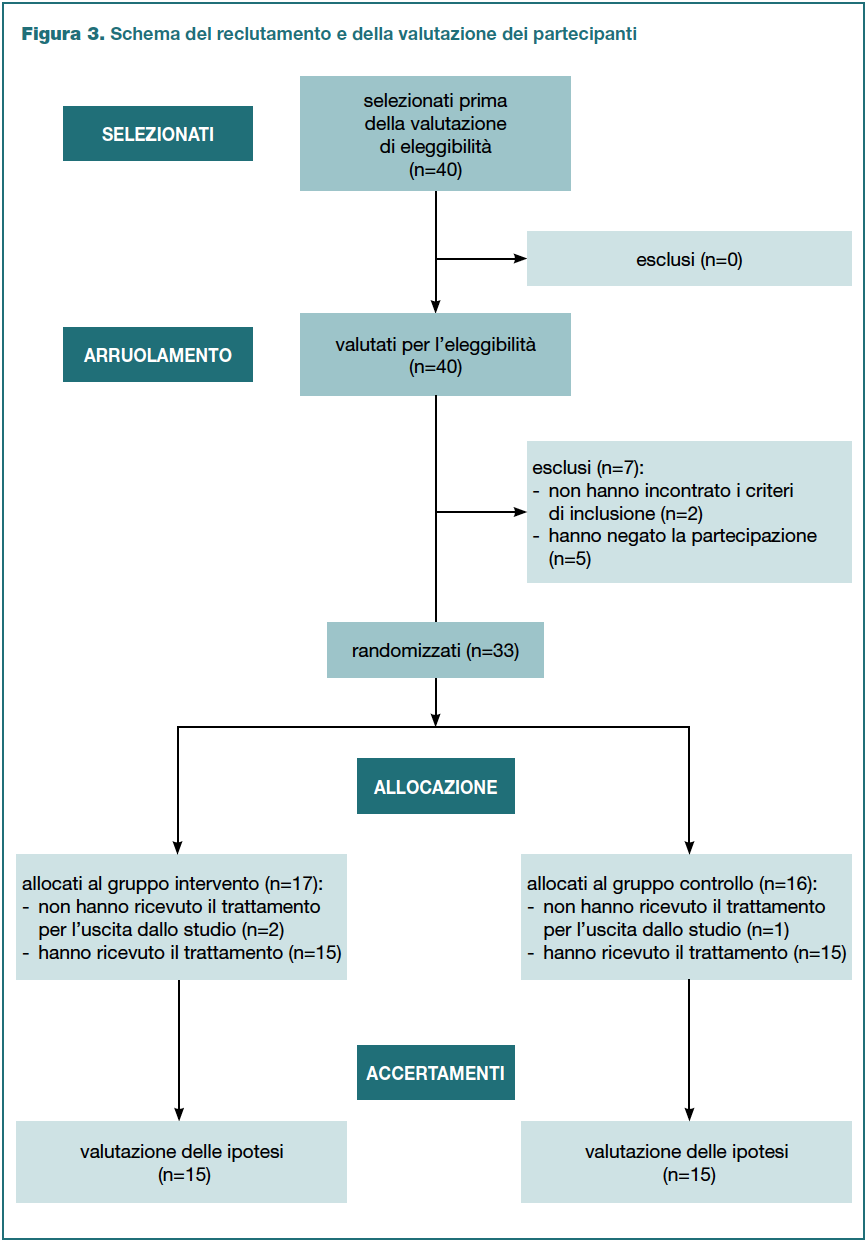
Dalla popolazione sono stati selezionati e valutati per l’eleggibilità allo studio 40 pazienti. Tramite i criteri di campionamento sono stati esclusi due soggetti che hanno presentato una pregressa patologia che comprometteva la mobilità corporea. Dei 38 soggetti ai quali è stato richiesto il consenso per la partecipazione cinque lo hanno negato. Sono stati randomizzati 33 pazienti, ma dopo l’impianto tre hanno manifestato la volontà di uscire dallo studio. Al termine del reclutamento l’analisi dei dati è stata elaborata su 30 pazienti (Figura 3: Flow diagram secondo Eldridge et al., 2016).
Descrizione dei gruppi di studio
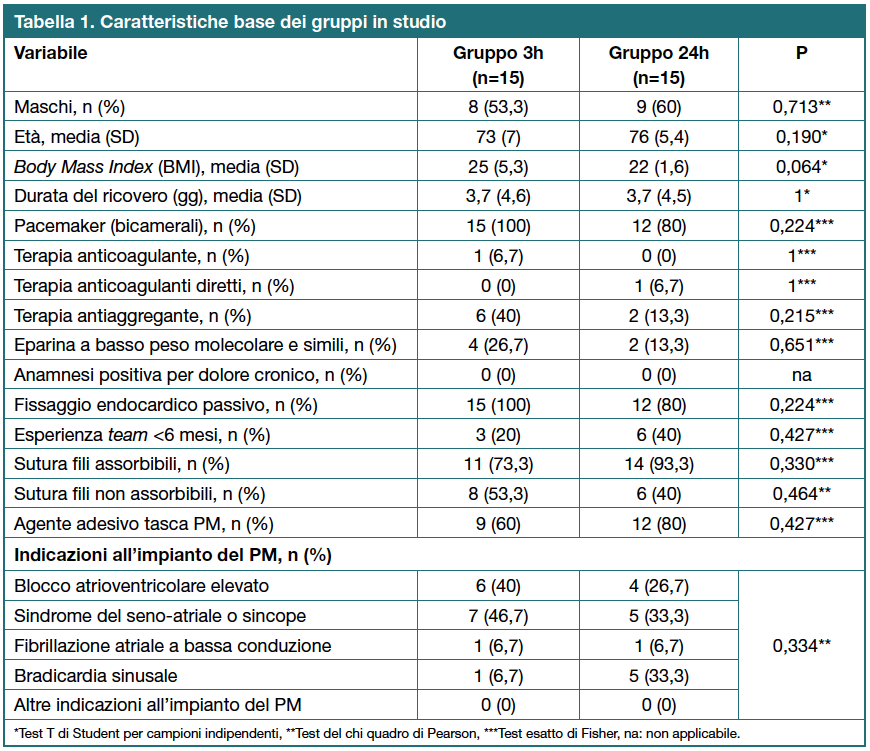
Sono stati inclusi 30 pazienti (Tabella 1): 15 mobilizzati dopo almeno tre ore (gruppo 3h) dall’impianto e 15 dopo 24 ore (gruppo 24h). I due gruppi in studio erano composti prevalentemente da pazienti di sesso maschile con un’età media di circa 75 anni. Le motivazioni cliniche più comuni per l’impianto di uno stimolatore cardiaco permanente sono state la diagnosi di blocco atrioventricolare elevato, la sindrome del seno-atriale o sincope. Per nessuna delle variabili considerate sono state evidenziate differenze significative (p<0,05) nel confronto fra i due gruppi di studio.
Complicanze
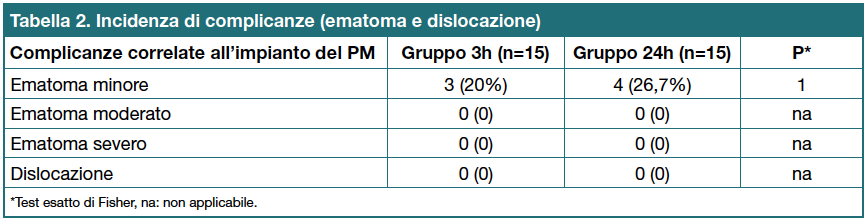
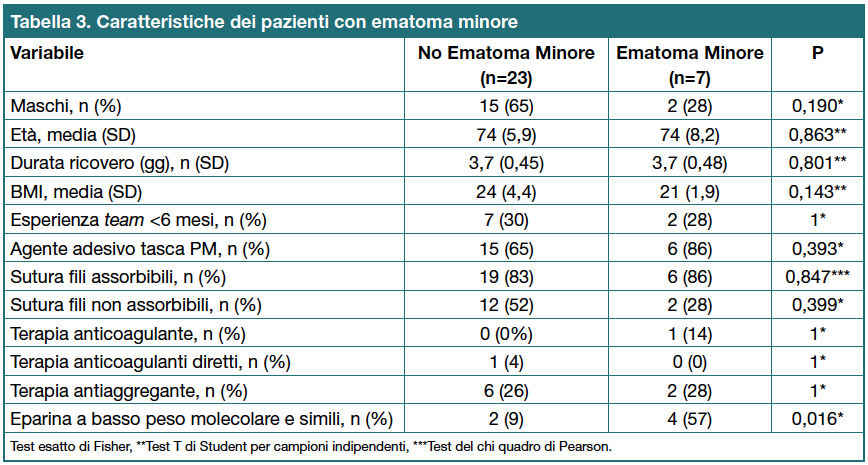
L’incidenza di ematoma minore era più alta nel gruppo 24h (n=4, 26,7%) rispetto al gruppo 3h (n=3, 20%), questa differenza tuttavia non era statisticamente significativa (p=1).
Non sono state descritte altre complicanze emorragiche (ematoma moderato o severo), né casi di dislocazione, nei soggetti di entrambi i gruppi di studio (Tabella 2).
Dolore
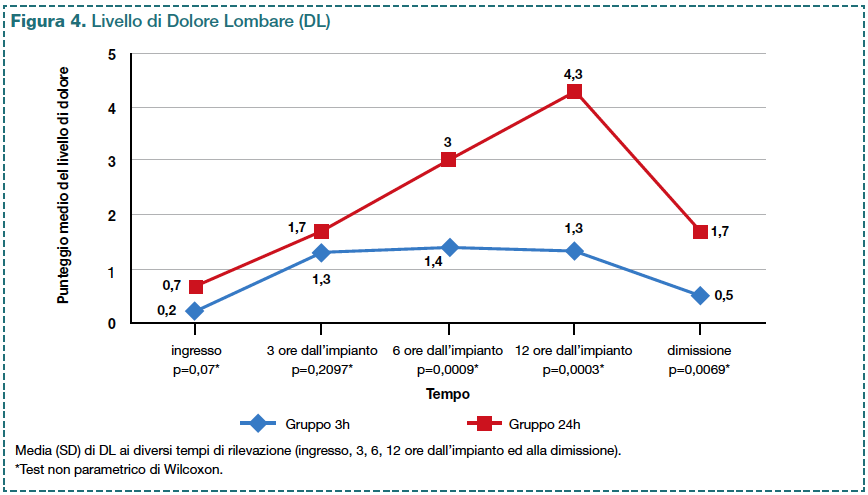
Il gruppo 3h ha registrato livelli medi di DL minori rispetto al gruppo 24h, tali differenze sono risultate significative dopo 6 e 12 ore dall’impianto e alla dimissione dei pazienti (p<0,05; Figura 4).
A nessun paziente del gruppo 3h è stato somministrato un analgesico per DL mentre il 33,3% (n=5) del gruppo 24h ha assunto farmaci analgesici (p=0,042).
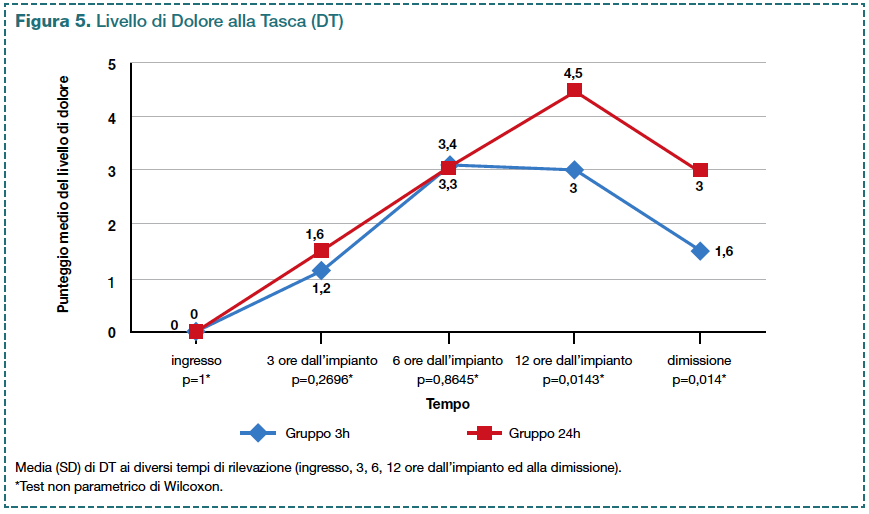
Il gruppo sottoposto a mobilità precoce rispetto al gruppo di controllo ha avuto livelli di DT inferiori sia dopo 12 ore dall’impianto del PM sia alla dimissione. Tali differenze erano statisticamente significative (p<0,05; Figura 5).
Il 46,7% (n=7) dei pazienti di entrambi i gruppi (p=1) ha ricevuto la terapia analgesica per DT.
In linea con i dati sopradescritti, l’analisi della covarianza, aggiustata per alcune variabili confondenti, ha mantenuto la significatività nelle differenze dei delta di dolore medio (p=0,0001 DL; p=0,0003 DT).
Analisi dei fattori di rischio
L’assunzione di eparina a basso peso molecolare (EBPM) o simili il giorno dell’impianto sembra essere un fattore associato al rischio di sviluppo di ematoma minore (Tabella 3).
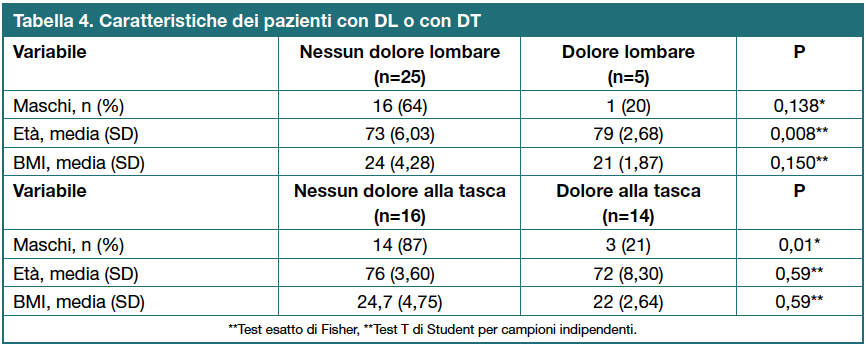
L’età avanzata e il sesso femminile sembrano essere associati, rispettivamente, a DL e a DT (Tabella 4). Il BMI medio è risultato non significativamente inferiore nei soggetti con dolore (DL: p=0,150; DT: p=0,59; Tabella 4).
DISCUSSIONE
Questo studio ha verificato gli effetti di una mobilizzazione precoce a 3h dall’impianto di un PM sulla sicurezza dei pazienti, rispetto a un riposo a letto protratto di 24h. In particolare, negli individui che hanno ricevuto la mobilizzazione precoce è stata descritta la riduzione significativa del dolore (DL e DT) nel periodo post operatorio. Inoltre, i casi di ematoma minore sono avvenuti in maggioranza nei soggetti con periodo di riposo a letto protratto rispetto a quelli che si sono alzati dopo sole tre ore ma senza una significatività statistica del dato.
Alcune complicanze considerate da questa analisi in fase di progettazione (ematoma moderato o severo, dislocazione degli elettrocateteri del PM) non si sono verificate nei pazienti durante il periodo di osservazione previsto sebbene precedenti ricerche (Nowak et al., 2015; Simonelli et al., 2014; Van Ecket al., 2007) le avessero registrate durante il ricovero. È probabile che l’esiguità nei dati ottenuti sia riconducibile all’assenza del controllo di follow up oppure alla dimensione limitata del campione incluso. Infatti, uno studio sperimentale (Miracapillo et al., 2006), che ha valutato l’effetto della mobilità a tre ore dall’impianto per un campione di 57 pazienti, ha descritto un’incidenza del 50% (n=2) dei casi di dislocazione a due mesi dall’impianto.
A riguardo, è opportuno considerare che gli ospedali con ridotti volumi procedurali di elettrofisiologia (<750 interventi all’anno) hanno mostrato un incremento del rischio di complicanze rispetto ai centri che praticano un maggior numero di interventi (p<0,05; Kirkfeldt et al., 2014). Il centro ospedaliero dove è stata realizzata questa ricerca potrebbe essere considerato a basso rischio di complicanze perché durante il periodo di studio ha prodotto un notevole numero di procedure di elettrofisiologia (860 interventi di cardio-stimolazione nel 2014; Aritmologia I.R.C.C.S. Monzino, 2016).
I pazienti del gruppo 24h hanno dimostrato livelli superiori di DL e, come conseguenza, un maggiore ricorso a farmaci analgesici rispetto ai pazienti mobilizzati dopo 3h.
Numerosi studi (Chair et al., 2003, 2004; Pollard et al., 2003; Rezaei-Adaryani et al., 2009) hanno evidenziato che l’aumento del tempo di immobilità a letto è proporzionale all’incremento dei livelli di DL; d’altro canto la riduzione dell’immobilità dei pazienti, dopo un intervento, viene descritta (Mohammady et al., 2014) come un fattore protettivo per tale sintomo (odds ratio: 0,45, IC95% da: 0,28 a 0,71).
Osservando le variazioni dei livelli medi di DT fra i gruppi è evidente che il gruppo 3h, dopo il periodo breve di allettamento, ha avuto una riduzione progressiva del livello di dolore, invece il gruppo 24h ne ha avuto un aumento; questo dato potrebbe indicare un effetto benefico della mobilizzazione ricevuta.
Rispetto a questo, è utile notare che il ricorso ad analgesici per DT è stato registrato in circa la metà dei soggetti inclusi; questa descrizione è coerente con altri risultati nei quali la maggiore intensità del dolore alla zona chirurgica è stata riferita dai pazienti durante i primi tre mesi dopo l’impianto (Findikoglu et al., 2015).
Nelle indagini precedenti, riguardanti i pazienti con dispositivo cardiaco, il caso di ematoma della tasca è stato definito con differenti indicatori di esito; tale eterogeneità ha portato a ottenere risultati fortemente variabili in termini di frequenza di complicanze emorragiche (dal 3,5% al 33%; De Sensi et al., 2015).
L’utilizzo di un trattamento eparinico nel periodo perioperatorio viene descritto nei pazienti che erano in terapia anticoagulante orale a domicilio; tale scelta terapeutica, denominata heparin bridging, è stata associata all’incremento del rischio di ematoma sia dopo l’impianto sia a seguito di altre procedure di intervento (sostituzione o revisione) sul dispositivo cardiaco (De Sensi et al., 2015; Birnie et al., 2013). I risultati del nostro studio sembrano confermare tale relazione.
L’età avanzata è stata associata al DL, mentre il genere femminile al DT. Nonostante questo, l’intervento di mobilità precoce nell’analisi di covarianza ha mantenuto effetti significativi sui livelli di dolore anche dopo gli aggiustamenti per tali caratteristiche (sesso, età e somministrazione di analgesici).
Precedenti ricerche (Chair et al., 2004; Simonelli et al., 2014) hanno anche identificato il BMI ridotto dei pazienti come elemento predittivo di DL; questa osservazione è stata in parte confermata dai risultati che hanno descritto un BMI medio inferiore nei i pazienti con DL o DT. Tuttavia questi dati non hanno raggiunto la significatività statistica.
Nel presente studio sono individuabili alcuni limiti:
- l’assenza delle pratiche di blinding a causa della natura visibile dell’intervento di mobilità. Tuttavia, per cercare di ridurre questo limite agli operatori coinvolti (ricercatore primario, infermieri, statistici) è stata assegnata solamente una singola responsabilità nell’attuazione di questa ricerca (allocazione dei partecipanti, attuazione degli interventi e raccolta dati, analisi statistica);
- la ridotta dimensione campionaria che può aver avuto impatto sull’assenza di significatività statistica in alcuni esiti;
- la perdita di una quota di soggetti che inizialmente erano stati reclutati nello studio (attrition bias).
CONCLUSIONI
Sulla base dei risultati di questo studio, la mobilizzazione precoce a tre ore dall’impianto di PM sembrerebbe avere un impatto positivo sull’esito dolore.
Tuttavia, si ritiene che siano necessari studi sperimentali ulteriori che prendano in esame un campione di dimensioni maggiori.
Conflitti di interesse: nessuno dichiarato.
Finanziamenti: la ricerca è stata sostenuta economicamente dal finanziamento di Ricerca Corrente del Ministero della Salute Italiana (RC2607176; EF12) e con le donazioni, spontanee e non vincolanti, di Boston Scientific S.p.A. e St. Jude Medical Italia S.p.A.
[1] La sequenza delle assegnazioni è stata creata utilizzando la pagina web: https://www.random.org/sequences/ (consultata il 21.07.2014).