INTRODUZIONE
La malattia di Parkinson (MP) è una patologia cronica, neurodegenerativa e progressiva, caratterizzata dalla morte dei neuroni dopaminergici. Questo processo causa un deficit nella produzione di dopamina, che è a sua volta responsabile delle manifestazioni motorie tipiche della malattia (Church, 2021) (Rahakrishanan et al., 2018).
In Italia sono stimati 170 mila casi prevalenti, riscontrando una lieve maggioranza per il sesso maschile e con una durata media di malattia fra i 14-15 anni (Vanacore, 2004). La sua incidenza aumenta con l’avanzare dell’età, interessando circa l’1% dei soggetti di età superiore a 65 anni (Church, 2021) (Rahakrishanan et al., 2018). I tassi di incidenza raggiungono infatti i numeri più elevati fra i 70 e i 79 anni (Vanacore, 2004).
Attualmente è una patologia per cui non esiste una vera e propria cura, ma per cui è invece previsto un trattamento unicamente sintomatologico che ne possa rallentare la progressione (Church, 2021).
I sintomi caratteristici sono il tremore a riposo, la bradicinesia e la rigidità muscolare che sono responsivi al trattamento farmacologico e vengono anche detti sintomi cardine (Hausdorff et al., 2009) (Lieber et al., 2015).
Ulteriori sintomi, difficilmente responsivi ai trattamenti, si sviluppano negli stadi avanzati di malattia (Hausdorff et al., 2009) (Lieber et al., 2015) (Brandmeir et al., 2018). Fra questi il più debilitante è l’instabilità posturale (IP) (Nilsson et al., 2011) (Crouse et al., 2016) che rappresenta la principale fonte di disabilità e di perdita di autonomia nel Parkinson (Hausdorff et al., 2009).
L’intervento neurochirurgico di Deep Brain Stimulation, o più comunemente detto DBS, è una procedura neurochirurgica utilizzata nel trattamento della MP (Lieber et al., 2015) (Krauss et al., 2021) (Fariba et al., 2022) e consiste nel posizionamento di un elettrodo intracranico, collegato con un generatore di impulsi (Krauss et al., 2021) (Fariba et al., 2022).
La DBS viene utilizzata per il trattamento, complementare o alternativo, nei casi in cui la terapia medica dovesse fallire (Tagliati, 2008) (Nilsson et al., 2009). Il punto di forza del trattamento chirurgico è quello di poter consentire una stimolazione costante nel tempo, permettendo così una riduzione del dosaggio farmacologico (Nilsson et al., 2009).
L’intervento consentirebbe inoltre un miglioramento dei sintomi che sviluppano resistenza alla terapia dopaminergica, quali tremore a riposo, bradicinesia e rigidità muscolare (Brandmeir et al., 2018) (Karachi et al., 2019) (Sidiropoulos et al., 2013); ancora invece non sono chiari gli effetti sui vari sintomi assiali, in particolare sull’IP (Brandmeir et al., 2018) (Tagliati, 2008) (Sidiropoulos et al., 2013).
Le strutture che sono più comunemente utilizzate per l’impianto di stimolazione profonda sono il Nucleo Subtalamico o STN ed il Globo Pallido interno o GPi (Fariba et al., 2022).
Recentemente, però, per poter ottenere un miglioramento delle problematiche di andatura e postura, è ritenuto opportuno mirare il trattamento a zone quali: il Nucleo Cuneiforme o CuN (Bourilhon et al. 2022) il Nucleo Peduncolo-Pontino o PPN (Moreau et al., 2008), di cui ne fa parte anche la Zona Caudale incerta o cZi (Khan et al. 2011) e che è collegato al campo H di Forel o FF (Rocha et al. 2021).
Le cadute accidentali ed il rischio di cadute nel Parkinson sono purtroppo frequenti (Nilsson et al., 2009). È infatti dimostrato che tale rischio aumenti in diretta correlazione con la progressione di malattia (Grabli et al., 2012) e che alla base di tali eventi c’è proprio l’instabilità posturale (Lieber et al., 2015) (Crouse et al., 2016).
Le cadute, a loro volta, provocano un aumento nel rischio di mortalità ed in quello di poter sviluppare morbilità. In aggiunta, la disabilità che ne deriva potrebbe risultare in una perdita di autonomia, nella diminuzione della qualità di vita e nella manifestazione della cosiddetta “paura di cadere” (FOF) (Grabli et al., 2012) e nell’isolamento sociale (Crouse et al., 2016). La maggior parte delle cadute avvengono durante lo svolgimento di attività funzionali di vita quotidiana (Grabli et al., 2012) (Nilsson et al. 2009), quando l’equilibrio viene messo alla prova da perturbazioni intrinseche (Crouse et al., 2016) (Nilsson et al., 2009). I fattori contribuenti lo sviluppo di tali eventi, quindi, sono tutte quelle problematiche motorie che intaccano l’equilibrio e la postura (Nilsson et al., 2009).
Per la prevenzione delle cadute vengono considerati i fattori clinici predittivi come le precedenti cadute, la FOF o anomalie del tono e della postura (Grabli et al., 2012); ma soprattutto possono essere sfruttati i test clinici che sono semplici, economici e che possono riflettere le attività di vita quotidiana (Nilsson et al., 2009).
OBIETTIVO
Con questa revisione è stato posto l’obiettivo di ricercare in letteratura prove di efficacia circa l’utilità di DBS sul rischio di caduta nei soggetti affetti da MP.
METODI
Tipo di studio
È stata condotta una revisione narrativa della letteratura attraverso la consultazione della banca dati Pubmed. Si sono ricercate anche fonti relative alla “letteratura grigia” (quali conference papers, articoli di riviste specialistiche) e Google Scholar, al fine di avere uno sguardo più ampio sull’argomento oggetto di disamina.
Criteri di eleggibilità
I criteri di inclusione sono stati oggetto di concordanza e costante valutazione da parte dei due autori (GM; ET) ed eventuali questioni hanno previsto l’intervento dirimente del terzo autore (GA).
Tipologia di studi
Per la realizzazione di questa revisione sono stati inclusi studi:
– Prospettici di coorte.
– Prospettici condotti in doppio cieco.
– Retrospettivi di coorte.
Durata del follow-up
Non sono stati posti limiti alla durata del follow-up descritta dagli studi.
Lingua
Sono state prese in considerazione pubblicazioni in lingua inglese.
Timing
Sono stati inclusi studi pubblicati dal 2008 al 2022.
Criteri di esclusione
La ricerca ha escluso:
– Studi su singolo caso.
– Studi pubblicati su banche dati diverse da Pubmed e non accessibili presso l’istituto di appartenenza.
Critical Appraisal
La valutazione critica della qualità degli studi inclusi è stata effettuata in cieco da parte degli autori.
Pico frame-work
La strategia di ricerca si è avvalsa della formulazione del PICO frame-work per esplicitare Popolazione, Intervento, Controllo (eventuale) ed Outcomes (Richardson et al. 1995).
P: persone affette da malattia di Parkinson
I: intervento neurochirurgico di stimolazione cerebrale profonda
C: //
O: evento cadute accidentali.
Fonti di informazione e Ricerca condotta
Le stringhe di ricerca derivate dalla consultazione delle banche dati sopra menzionate, con le relative keywords e Mesh terms, sono rappresentate in tabella 1.
Tabella 1 – keywords e Mesh terms.
| KEYWORDS | MESH TERMS | FILTRI | STRINGA DI RICERCA | |
| PUBMED | Parkinson Disease | Parkinson Disease | “Humans”, “Full Text” e “From 2008 to 2022” | ((“Parkinson Disease”[Mesh]) AND “Deep Brain Stimulation”[Mesh]) AND “Accidental Falls”[Mesh] |
| Deep Brain Stimulation | Deep Brain Stimulation | |||
| Falls | Accidental Falls | |||
| Parkinson Disease | Parkinson Disease | “Humans”, “Full Text” e “From 2008 to 2022” | (((Dbs) OR (Deep brain stimulation)) AND (Parkinson disease)) AND (Falls) | |
| DBS | DBS o Deep Brain Stimulation | |||
| Falls | Falls |
Selezione degli studi
Come può essere osservato nella Flow Chart (Figura 1), dalla consultazione della banca dati e le due appartenenti stringhe di ricerca, sono risultati in tutto 125 articoli e dopo l’eliminazione dei doppioni e la lettura dell’abstract, vengono esclusi 103 articoli risultati non pertinenti, ne rimangono 23 di cui è stato richiesto il full text. Il processo di selezione ha infine portato ad ottenere 14 articoli soltanto, considerati idonei per rispondere al quesito di ricerca.
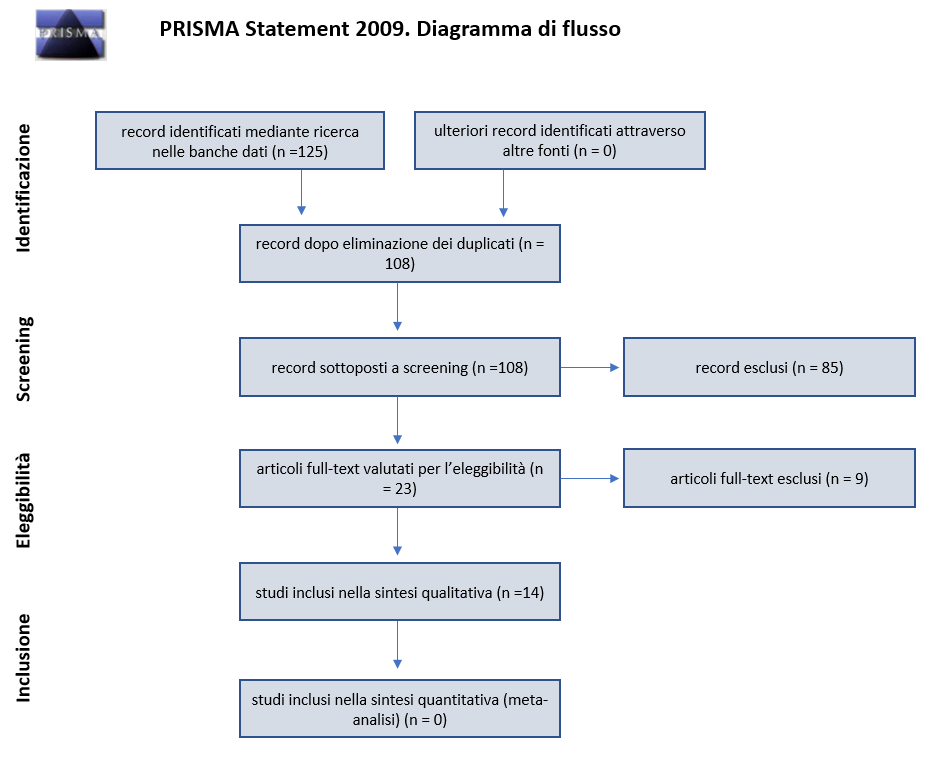
Figura 1 – Flow Chart.
Rischio di bias negli studi individuati
In seguito vengono raffigurate la tabella per il rischio di bias negli studi che sono stati presi in considerazione e la relativa legenda di interpretazione (Figure 2 e 3).

Figura 2 – Didascalia.
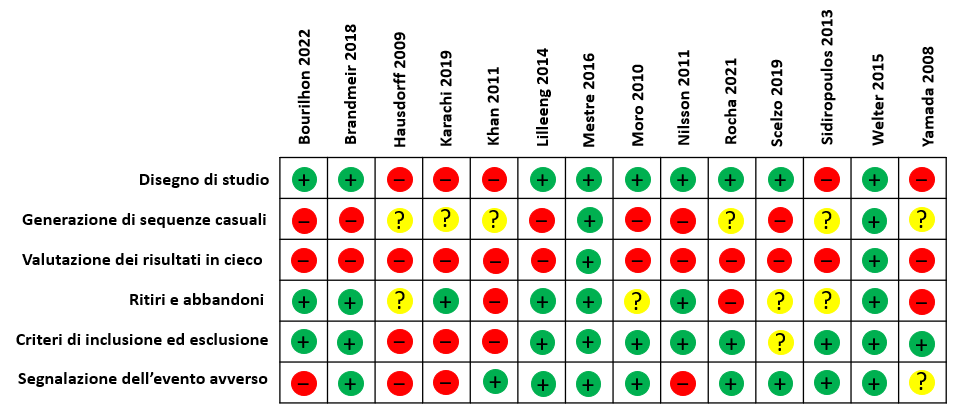
Figura 3 – Risk of bias table.
RISULTATI
Dalla ricerca effettuata sono stati riscontrati in tutto 125 articoli e, dopo un’attenta selezione, ne sono stati inclusi solo 14 con date di pubblicazione comprese fra il 2008 e il 2022 (Tabella 2). È noto che gli articoli selezionati avessero in comune l’impiego di DBS nei soggetti affetti da MP, per poterne analizzare i cambiamenti per le diverse problematiche correlate al rischio di caduta.
Per questa revisione sono stati quindi inclusi, in ordine, i seguenti studi: Yamada et al. del 2008; Hausdorff et al. del 2009; Moro et al. nel 2010; Khan et al. del 2011; Nilsson et al. del 2011; Sidiropoulos et al. del 2013; Lilleeng et al. del 2014; Welter et al. del 2015; Mestre et al. del 2016; Brandmeir et al. nel 2018; Karachi et al. del 2019; Scelzo et al. del 2019; Rocha et al. del 2021; e Bourilhon et al. 2022.
Tabella 2 – Gli studi selezionati.
| Titolo | Effect of bilateral subthalamic nucleus stimulation on levodopa – unresponsive axial symptoms in Parkinson’s disease. | Deep brain stimulation effects on gait variability in Parkinson’s disease. | Unilateral peduncolopontine stimulation improves falls in Parkinson’s disease. |
| Autore, anno | Yamada K. et al. 2008 | Hausdorff J.M. et al. 2009 | Moro E. et al. 2010 |
| Obiettivo | Indagare gli effetti di STN-DBS bilaterale sui sintomi assiali non responsivi ad L-dopa. | Osservare gli effetti della STN-DBS sull’IP per avere maggiori informazioni riguardo l’aumento del rischio di cadute, comparando gli effetti della DBS con quelli della L-dopa. | Investigare la sicurezza e gli effetti che derivano dall’impianto di PPN-DBS unilaterale sui sintomi motori, nello specifico: sulle cadute, FOG e IP |
| Setting | Dipartimento di Neurochirurgia, ospedale di Kumamoto, Giappone | Sourasky Medical Center, Israele | Toronto Western Hospital, Toronto, Canada |
| Campione, criteri di campionamento | 29 pazienti con MP idiopatica avanzata sottoposti a STN-DBS con età 66,6 +/- 7,2.
Criteri di esclusione: grave demenza punteggio 4 su UPDRS; punteggio < 20 sulla MMS; sintomi psichiatrici maggiori non controllati; e grave depressione. |
13 pazienti con MP avanzata di età 63,6 aa, di cui 3 donne, sottoposti a STN-DBS bilaterale. Durata media di malattia di 12,9 aa; studiati per 12 mesi dopo l’intervento. La dose media quotidiana di L-dopa per ciascuno era 946 mg e 700 mg, prima e dopo la chirurgia | 6 pazienti impiantati con PPN-DBS unilaterale. Criteri di inclusione: MP idiopatica; età < 70 aa; con periodi Off e peggiori sintomi assiali, con cadute e limitazioni nelle ADL; senza anomalie cerebrali; e senza gravi co-morbilità mediche e psichiatriche o demenza |
| Disegno
Materiali e metodi |
Analizzati individualmente i sintomi motori (bradicinesia, tremore, e sintomi assiali).
Analizzati anche 6 punteggi parziali di UPDRS che costituiscono le caratteristiche assiali (caduta, freezing, andatura, standing, postura ed IP). |
Studio Prospettico di coorte
L’andatura e la scala UPDRS (parte III) sono state valutate: –On DBS/Off dopa: terapia medica interrotta 12h prima -Off DBS/Off dopa: disattivata poi anche la DBS -Off DBS/On dopa: una volta efficace la terapia somministrata -On DBS/On dopa: per ultimo è riattivato anche il sistema DBS. |
Studio Prospettico condotto in doppio cieco
La scala UPDRS parte III, il tapping test ed il test del cammino utilizzati per valutare gli effetti motori prima e dopo PPN-DBS. La scala UPDRS parte II utilizzata per valutare le cadute ed il FOG. Valutazioni a 3 e 12 mesi dopo l’intervento Valutazioni nello stato Off/On dopa, dopo 1 settimana di assegnazioni casuali. Valutazione ripetuta dopo un’altra settimana invertendo la stimolazione
|
| Timing | dal 2001 al 2005 | // | da 2006 a 2008 |
| Risultati e conclusioni | Dopo l’intervento il dosaggio medio di L-dopa è diminuito del 27%. La reattività preoperatoria per freezing, andatura, postura e IP erano positivamente correlate con il miglioramento postoperatorio senza terapia. Per ogni sintomo assiale alcuni pz hanno mostrato un’eccellente risposta a STN-DBS. Dai risultati si deduce che
pz con buoni punteggi preoperatori subiscono un miglioramento dei sintomi non responsivi a L-dopa. Si conferma che l’effetto di STN-DBS è limitato. |
On DBS/On dopa le misurazioni sono migliorate significativamente, eccetto il tempo medio di falcata. No differenze importanti per le condizioni intermedie.PunteggioUPDRS migliorato significativamente con DBS e/o terapia medica aggiunte. OnDBS maggiore contributo nel miglioramento della stabilità posturale e dell’andatura, associati al rischio di cadute. | No importanti differenze motorie a 3 o 12 mesi nei casi On/Off DBS. Miglioramento significativo cadute in On/Off. Miglioramento punteggi soggettivi UPDRS-II a 3 mesi e miglioramento di alcune misure oggettive. A 12 mesi, solo la caduta rimane migliore in maniera significativa. UPDRS II e III forse non sono gli strumenti migliori per valutare andatura e FOG nella MP. |
| Titolo | Outcomes from stimulation of the caudal zona incerta and peduncolopontine nucleus in patient with parkinson’s disease. | Fear of falling and falls in people with Parkinson’s disease treated with deep brain stimulation in the subthalamic nuclei. | Low-frequency subthalamic nucleus deep brain stimulation for axial symptoms in advanced Parkinson’s disease. |
| Autore, anno | Khan S. et al. 2011 | Nilsson M.H. et al. 2011 | Sidiropoulos C. et al. 2013 |
| Obiettivo | Determinare l’efficacia di PPN-DBS bilaterale, in combinazione con patine la cZi nell’alleviare i sintomi assiali (IP, cadute e fallimento dell’inizio della deambulazione). | Verificare se la paura di cadere, le cadute e le quasi cadute, si presentano anche dopo l’impianto di STN-DBS
Si sono descritte le circostanze di ogni caduta/quasi caduta. |
Analizzare gli effetti di HFS ed LFS in pazienti con STN-DBS.
Confermare i precedenti risultati positivi secondo cui LFS può essere utile per trattare l’IP e i disturbi dell’andatura. |
| Setting | Dipartimento di Neurochirurgia, università di Bristoll, Regno Unito | Lund University Hospital, Svezia | Toronto Western Hospital, Toronto, Canada |
| Campione, criteri di campionamento | 7 pazienti con sintomi assiali predominanti in entrambi gli stati On/Off L-dopa. Età 41,6 +/- 15,3. | 24 pazienti con MP sottoposti a STN-DBS bilaterale. Età media 65,3 aa, durata media di malattia 12,7 aa.
3 pz esclusi per severe co-morbilità e 1 pz escluso per un re-intervento.1 pz escluso perché non in grado di sostenere il follow-up ad un anno. Rimasti 19 soggetti |
45 pazienti con MP, 35 maschi, 10 femmine di età media 59,5 aa; durata media di malattia di 17,8 aa sottoposti a STN-DBS con HFS.
Criteri di inclusione: perdita del beneficio assiale; nessun beneficio nonostante il trattamento medico e/o fisioterapico; presenza di severa ipotonia da sola o con altri sintomi assiali. |
| Disegno
Materiali e metodi |
Valutazione dei pz con esiti motori con parte motoria di UPDRS, con punteggio parziale derivato dagli item 27, 28, 29, 30. La qualità della vita è stata valutata utilizzando il PDQ39. i confronti sono stati fatti tra punteggi basali e quelli di follow-up a 3 e 12 mesi. | Studio Prospettico di Coorte
Valutazioni motorie fatte prima ed 1 anno dopo l’intervento con BBS e UPDRS. Prima: valutati prima della decisione per DBS ed una settimana prima dell’impianto. I test eseguiti prima in Off e poi On dopa. 1 anno dopo: i test Off dopa sono eseguiti in due giorni, prima Off e poi On DBS. Valutazioni poi ripetute On dopa e On DBS. Utilizzati anche FES e SAFFE. Cadute e quasi cadute registrate su diario |
studio prospettico di coorte
Valutazioni fatte prima con HFS e dopo con LFS. Misurazioni primarie: punteggio motorio UPDRS, i punteggi assiali e dell’andatura. Risultati secondari: i punteggi parziali del parlato e del n.di cadute riferite. Il n. delle cadute così classificato:No falls; rare; Monthly; Weekly; Daily.
|
| Timing | 2010 | dal 2003 al 2006 | // |
| Risultati e conclusioni | Off-dopa PPN e cZi DBS non ha migliorato UPDRS tot. La stimolazione combinata ha un miglioramento del 9,2% in UPDRS motorio, anche se non statisticamente significativo.
On-dopa nessuno tra cZi e PPN si traduce in miglioramento significativo di UPDRS motoria, ma miglioramenti nel tremore farmacologico, rigidità e bradicinesia. Nei pazienti quindi i maggiori risultati si sono ottenuti su UPDRS parte 3, corrispondendo ad un miglioramento di QOL. Si dimostra un miglioramento dei sintomi assiali con questa DBS. |
Punteggio SAFFE migliorato. Il punteggio FES no rilevanza statistica. Punteggio IADL migliorato significativamente. Il tasso di quasi cadute è diminuito in modo significativo. No differenze nel tasso di cadute.
I risultati non dimostrano una differenza significativa per le cadute (ridotta dimensione del campione). |
No miglioramento in nessun outcome primario con LFS. Il n° di cadute non cambia con LFS, risultati migliori con HFS. Solo 12 pz hanno tenuto LFS. No miglioramento significativo dei sintomi assiali con LFS.
Se LFS è del tutto efficace, i miglioramenti non riscontrati con scale standard come l’UPDRS. |
| Titolo | Motor Symptoms after deep brain stimulation of the subthalamic nucleus. | PPNa-DBS for gait and balance disorders in Parkinson’s disease: a double-blind, randomised study. | Long-Term Double-Blinded Unilateral Peduncolopontine Area Stimulation in Parkinson’s Disease. |
| Autore, anno | Lilleeng B. et al. 2014 | Welter M.L. et al. 2015 | Mestre T.A. et al. 2016 |
| Obiettivo | Esaminare gli effetti a lungo termine della STN-DBS sullo sviluppo dell’instabilità posturale e fenotipo di difficoltà di andatura (PIGD), FOG e cadute. | Valutare gli effetti di PPNa-DBS in pazienti con MP che presentano problematiche di andatura ed equilibrio resistenti alla L-dopa. | Determinare l’efficacia a lungo termine di PPN-DBS unilaterale per compromissioni di andatura ed equilibrio non responsive alla terapia nella MP. |
| Setting | Centro dei disturbi del movimento, ospedale di Stravanger, Norvegia. | Ospedale di Pitié-Salpetrère, dipartimento di Neurologia, Parigi, Francia | Divisione di Neurologia, Toronto Western Hospital, Toronto, Canada. |
| Campione, criteri di campionamento | 28 pazienti operati 6-9 anni prima, ma solo 16 sono stati inclusi.
Criteri di inclusione: con MP, test stimolante L-dopa positivo; discinesie non responsive a L-dopa; e problematiche di On/Off. Criteri di esclusione: demenza o grave malattia psichiatrica; marcata atrofia cerebrale alla RMN; età > 75aa. |
6 pazienti con meno di 71aa, forma grave di MP; con problematiche di andatura e/o equilibrio solo parzialmente responsive alla terapia (item cadute, FOG ed IP della UPDRS con punteggio superiore o uguale a 2).
Criteri di esclusione: demenza (MDRS <129); disturbi psichiatrici; controindicazioni alla chirurgia; e lesioni cerebrali rilevabili alla RM. 2 pz non hanno completato lo studio per severi eventi avversi. |
9 pazienti con MP idiopatica con meno di 70aa, con andatura disabilitante, compromissioni di equilibrio, FOG con cadute refrattari anche con la terapia medica.
8 pazienti sono giunti alla prima valutazione a lungo termine e solo 6 alla seconda valutazione. |
| Disegno
Materiali e metodi |
Studio Prospettico di coorte.
I pz sono stati esaminati nel preoperatorio a 3 e 6 mesi per gli effetti a breve termine. Il follow up a lungo termine è stato poi eseguito dopo un anno e fra il 2011-12. Nel complesso l’esaminazione è durata 6-9 anni. Per le valutazioni la scala principalmente utilizzata è la UPDRS che con i suoi item ha reso possibile valutare ogni outcome.
|
Studio randomizzato, condotto in doppio cieco.
Le valutazioni sono state eseguite un mese prima della chirurgia, 4 e 6 mesi dopo l’intervento Off/ON DBS e Off/On dopa. La Rating Scale for Gait Evaluation (RSGE) è stata scelta come criterio principale per valutare deficit di andatura ed equilibrio. La disabilità nel Parkinson viene valutata con la UPDRS. Viene incluso anche il PDQ-39-SI per la qualità di vita.
|
Studio Prospettico, condotto in doppio cieco.
Le valutazioni cliniche sono state eseguite nel preoperatorio, a 2 e a 4 anni dopo l’intervento. I pz sono stati valutati Off ed On dopa/DBS. Ad ogni visita le valutazioni hanno incluso la UPDRS parte II, Hoehn e Yahr staging, il test del tocco ed il test del cammino. A fine studio è stata compilata MDS-UPDRS parte III. |
| Timing | dal 2003 al 2012 | // | Dal 2006 al 2008 (2010) |
| Risultati e conclusioni | Al follow-up a breve termine si osserva netto miglioramento del punteggio motorio UPDRS. Miglioramenti anche per tremore, bradicinesia, rigidità e punteggi PIGD.
A 6-9 anni tutti i pazienti presentavano un pattern PIGD dominante ed il 50% dei pazienti sviluppa FOG e/o cadute ricorrenti. STN-DBS quindi induce un miglioramento acuto dei sintomi della PGIDa lungo termine si ha una marcata progressione dei sintomi dopaminergici. |
No cambi significativi in RSGE ed UPDRS tra On ed Off DBS, nemmeno a confronto con il preoperatorio. 3 pz su 4 On DBS hanno subito una riduzione di cadute e FOG.
In particolare, UPDRS On DBS dimostra una ridotta frequenza di cadute e FOG in due pz e ridotta IP. Ed infine cadute e FOG si sono aggravate in un pz Off dopa e DBS. I risultati di DBS On dopa, non differiscono molto dai precedenti. I test tradizionali potrebbero non rilevare subdoli cambiamenti con PPN-DBS. PPN-DBS potrebbe alleviare FOG e deficit di equilibrio. |
A 2aa migliora significativamente FOG. A 4aa non sono associati cambi significativi, ma 4 risposte di miglioramento in cadute e FOG. PPN-DBS associata a miglioramento significativo del punteggio tot. di UPDRS parte II (in Off dopa). Anche nel follow up mediano fra i due sono riportati benefici sostanziali e non si sono rilevati effetti avversi permanenti. Si riscontra quindi iniziale beneficio, ma non duraturo, sicurezza a lungo termine e buona tollerabilità. Comunque, 1/3 dei pz presenta beneficio per cadute e FOG. |
| Titolo | Deep Brain Stimulation for Parkinson Disease Does not Worsen or Improve Postural Instability: A Prospective Cohort Trial. | Clinical and anatomical predictors for freezing of gait and falls after subthalamic deep brain stimulation in Parkinson’s disease patients. | Deep brain stimulation in Parkinson’s disease: a multicentric, long-term, observational pilot study. |
| Autore, anno | Brandmeir N.J. et al. 2018 | Karachi C. et al. 2019 | Scelzo E. et al. 2019 |
| Obiettivo | Valutare l’effetto della DBS (STN e GPi) sull’IP a 3 e 12 mesi.
Validare le misurazioni sfruttando anche le cadute auto-riportate. |
Determinare i fattori che contribuiscono al FOG e alle cadute, dopo l’intervento di STN-DBS.
Identificare i pazienti a rischio di sviluppare o aggravare il FOG o le cadute. |
Valutare l’impatto di DBS sullo sviluppo delle complicanze a lungo termine di malattia. |
| Setting | West Virginia University, WV, USA. | Brain and Spine Institute, Paris, Francia. | Ospedale Maggiore, Milano, Italia. |
| Campione, criteri di Campionamento | 55 pazienti, 44 per l’intervento, età media di 67 aa e con una durata di malattia di 7 aa.
– 18 pz non si sono presentati al controllo a 3 o 12 mesi; – 6 pz esclusi per mancanza di valutazione pre operatoria. No limitazioni di età, non test per la variabilità fra L-dopa ON/OFF. Esclusi i pz con DBS già impiantato. |
383 pazienti con MP con età media 54,8 aa.
52 pazienti esclusi da analisi statistiche ed analizzati i dati di 331 pazienti. 207 maschi, 124 femmine, con età media 57,7 aa e durata media di malattia di 12,5 aa. |
182 pz suddivisi a metà in due gruppi, uno con DBS (SC) e uno con trattamento L-dopa (MC). Sottoposti ad intervento fra 1998 e 2015.
87 pz hanno impiantato STN-DBS e 4 GPi-DBS. I pz erano tutti di età inferiore ai 70aa ed equamente divisi fra le due coorti fra i due generi. Solo 2 pz hanno avuto gravi complicanze a breve termine. |
| Disegno
Materiali e metodi |
Studio Prospettico di coorte.
Misurazioni fatte a 3 e 12 mesi dopo DBS (STN o GPi). I risultati di IP ottenuti da: TUG, BBS, UPDRS (pull test) e Biodex Stability System -Sway Index. I risultati sono stati comparati a misurazioni iniziali per osservare il cambiamento di IP. Outcomes primari: l’instabilità posturale e le cadute auto-riportate. UPDRS III e IV, rigidità, bradicinesia e tremore sono gli outcomes secondari. |
Studio Prospettico di coorte.
Valutazioni fatte a 3 mesi ed un anno dopo l’intervento. Il FOG e le cadute rispettivamente valutati con l’item 14 e 13 della UPDRS-II. Valutati con On/Off L-dopa. Sono stati misurati anche: la disabilità correlata alla MP, la gravità dei sintomi motori assiali e lo stato mentale (MDRS). |
Studio Retrospettivo di coorte.
Le valutazioni sono state fatte ad un T0, corrispondente ai 12 mesi antecedenti il reclutamento (T1). Come outcome principale si sono osservate le differenze fra SC ed MC sono state raggruppate e suddivise in tre categorie (correlate a MP, non correlate, e correlate a MP ma non a DBS).
|
| Timing | // | dal 1996 al 2013. | Dal 2013 al 2016. |
| Risultati e conclusioni | A 3 mesi: le cadute auto-riportate no differenze signficative rispetto al pre-operatorio; anche per outcomes secondari no differenze significative.
A 12 mesi: outcomes primari no significato statistico. UPDRS III e IV mostrano miglioramento clinico significativo. Per i risultati secondari di IP non si dimostra un miglioramento con rilevanza statistica. Ipotesi che DBS non peggiori l’instabilità posturale a 3 e 12 mesi. |
FOG, dopo STN-DBS, sono state rilevate differenze significative. Per le cadute: ad un anno, la severità delle cadute è diminuita in 83 ed aumentata in 75 pz.
I risultati dimostrano che FOG e cadute sono migliorate in circa 1/3 dei pazienti. Le cadute sono diminuite nel 25% dei pazienti. La gravità sembra essere legata a minor performance cognitiva. |
Il r. cadute è significativamente più basso in SC che in MC, mentre il r. di gravi cadute rimane più o meno simile. Non ci sono differenze dell’effetto di DBS sulle cadute nei pz con o senza riduzione di L-dopa. No differenze significative fra SC ed MC per la presenza di cadute a T0.
Quindi si deduce e si osserva una riduzione di cadute nella SC rispetto a MC. |
| Titolo | Fields of Forel Brain Stimulation Improves Levodopa-Unresponsive Gait and Balance Disorders in Parkinson’s Disease. | Stimulation of the peduncolopontine and cuneiform nuclei for freezing of gait and falls in Parkinson disease: Cross-over single-blinded study and long-term follow-up. |
| Autore, anno | Rocha M.S.G. et al. 2021 | Bourilhon J. et al. 2022 |
| Obiettivo | Testare l’efficacia di FF-DBS sui sintomi motori non responsivi alla levodopa, quali FOG, problemi di equilibrio, IP e cadute nella MP. | Esaminare gli effetti della PPN e CuN DBS, osservando il verificarsi di FOG e/o cadute a 24-36 mesi dopo l’intervento con l’utilizzo di scale cliniche e registrazioni. |
| Setting | Dipartimento di Neurologia e Neurochirurgia funzionale, Brasile. | Salpetrière Hospital, Parigi, Francia. |
| Campione, criteri di campionamento | 13 pazienti trattati con FF-DBS.
Criteri di inclusione: insorgenza di malattia sopra i 40aa; durata di malattia oltre i 5aa; stadio di Hoehn e Yahr >/= a 3; complicanze motorie associate a L-dopa; e documentati disturbi di andatura. Criteri di esclusione: pregresse operazioni per MP; uso continuo di ausili per il cammino; demenza; severa depressione o psicosi. No gravi eventi avversi. |
6 pz con MP seguiti per una media di 30,7 mesi. 5 uomini ed 1 donna, età media di 64,8aa. Durata media di malattia di 11,5aa. Scelti pz con una forma di resistenza a L-dopa. posizionata DBS che raggiunge la zona PPN e CuN.
Pz 04 ha eseguito solo la prima fase del follow-up per caduta con frattura dell’anca. |
| Disegno
Materiali e metodi |
Studio Prospettico di coorte.
Valutazioni cliniche, neurofisiologiche e strumentali di andatura prima ed un anno dopo l’intervento. Gli outcomes primari di valutazione erano il questionario FOG, il n. di cadute e la BBS. Gli outcomes secondari di misurazione erano la FES, MDS-UPDRS parte III e la scala Quality of Life (PDQ-39). |
Studio Prospettico condotto in singolo cieco.
Valutazioni 1 mese prima ed 1 anno dopo l’intervento, Off/On dopa. primo follow-up 5 pz con PPN ed 1 con CuN, valutati prima On DBS e dopo Off per 1h. Scambiati per i successivi 3-4 mesi: 4 pz con CuN ed 1 con PPN, ripetute le stesse valutazioni. Utilizzate UPDRS, GABS, Tinetti; FOG-Q, ABC, PDQ-39, MDRS, HAD |
| Timing | Dal 2019 al 2020 | // |
| Risultati e conclusioni | 35% riduzione di punteggio tot. FOG, insieme a 43% miglioramento BBS, il n. di cadute mensili ridotto dell’82%, mentre la FOF no significativa.
Quindi, miglioramenti significativi dopo FF-DBS per le problematiche di andatura. Si è vista anche una riduzione significativa di complicanze e sintomi motori e della qualità di vita. |
Significativa diminuzione nel punteggio Tinetti (PPN e CuN). No cambiamenti significativi nelle valutazioni motorie. Tra Off/On DBS no cambiamenti clinici significativi. 2-3 aa dopo intervento, On dopa DBS (CuN e PPN) non migliora andatura ed equilibrio, rispetto a prima o con Off DBS. No cambiamenti significativi nei punteggi clinici tra PPN e CuN. |
Dall’analisi degli articoli è emerso che, in correlazione al rischio di caduta, vengono considerati anche altri parametri come l’instabilità posturale, l’andatura, la paura di cadere (FOF), l’equilibrio e/o il freezing (FOG), il quadro sintomatologico di instabilità posturale e difficoltà di andatura (PIGD) e la qualità di vita (QOL).
In particolare: negli studi di Hausdorff et al. 2009, Sidiropoulos et al. 2013 e Brandmeir et al. 2018 viene analizzata la sola IP; negli articoli diMestre et al. del 2016, Karachi et al. 2019, di Rocha et al. del 2021e di Bourilhon et al. 2022 vengono osservate FOG e cadute; nello studio di Khan et al. 2011 sono valutate IP, cadute e QOL; Lilleeng et al. del 2014 nel suo articolo valuta il FOG, insieme alle cadute e a PIGD; negli articoli di Moro et al. 2010 e di Yamada et al. 2008 vengono ricercate il FOG, le cadute e l’IP; lo studio di Nilsson et al. 2011 va ad indagare le sole cadute, integrandole con le quasi cadute e la paura di cadere; ed infine lo studio di Welter et al. del 2015 valuta molti parametri tra cui cadute, FOG e QOL. Scelzo et al. del 2019 è l’unico a valutare nello specifico il numero di cadute ed il rischio di caduta.
Il metodo utilizzato da questi studi presi in considerazione resta pressoché sempre lo stesso: i pazienti vengono seguiti per un periodo di tempo più o meno lungo prima e dopo l’impianto di stimolazione cerebrale profonda. In genere, le valutazioni vengono infatti eseguite sia prima che dopo l’esecuzione dell’intervento, con follow-up più o meno lunghi.
Per poter eseguire la valutazione di tali problematiche correlate al rischio di caduta sono stati utilizzati anche alcune scale e test clinici, tra cui le più rappresentate sono, in ordine: la Unified Parkinson Disease Rating Scale (UPDRS), la Berg Balance Scale (BBS), il Parkinson Disease Questionnare (PDQ-39) e la Fall-Efficacy Scale (FES).
La UPDRS viene utilizzata in tutti gli articoli presi in considerazione per questa revisione, ad eccezione di uno. La BBS, il PDQ-39 e la FES sono meno rappresentate ed utilizzate spesso in combinazione con la prima.
Tra i vari studi sono state utilizzate però altre scale rappresentate con meno frequenza, infatti: Welter et al. 2015 nel suo articolo per le valutazioni primarie utilizza la Rating Scale for Gait Evaluation (RSGE); nell’articolo di Mestre et al. 2016 vengono inclusi la scala Hoehn &Yahr staging, il tapping test ed il walking test; in quello di Brandmeir et al. 2018 vengono utilizzati anche il test Timed Up and Go (TUG) ed il Biodex Stability System; Khan et al. 2021 e Bourilhon et al. 2022 oltre ad alcune delle scale già nominate includono il Freezing Of Gait Questionnare; lo studio di Bourilhon et al. 2022 è il solo invece ad aver utilizzato la scala Tinetti.
L’unico articolo in cui non viene seguita questa metodologia è quello di Scelzo et al. del 2019; questo perché si tratta di uno studio retrospettivo, in cui i dati, eventi avversi e sintomi dei pazienti vengono rilevati andando a ritroso nel tempo. Per questo motivo non vengono incluse ed utilizzate scale cliniche per la valutazione oggettiva.
CONCLUSIONI
A fronte dell’analisi di tali articoli, sono state tratte conclusioni discordanti circa l’utilità di DBS per il rischio di caduta.
Nello studio di Hausdorff et al. (2009) il punteggio motorio di UPDRS subisce un miglioramento, suggerendo quindi una diminuzione nel rischio di caduta con STN-DBS. Allo stesso modo in quello di Brandmeir et al. (2018) con STN-DBS si osserva un miglioramento significativo per UPDRS, mentre le cadute e l’instabilità posturale non mostrano cambiamenti significativi. Con Scelzo et al. (2019) STN e GPi DBS, se messa a confronto con la sola terapia medica, sembra invece avere effetti positivi sulla riduzione delle cadute. Con Nilsson et al. (2011), anche se il tasso per le cadute non manifesta cambiamenti significativi, dopo l’intervento di STN-DBS la paura di cadere diminuisce e meno attività vengono evitate per tale assenza di paura. L’articolo di Yamada et al. (2008) permette di dedurre che i pazienti che partono con buoni punteggi sono avvantaggiati nel subire un miglioramento dei sintomi assiali, per questo si può affermare che l’effetto di STN-DBS sia limitato. A confermare tale teoria c’è anche Lilleeng et al. (2014) che con questo studio, STN-DBS ha mostrato un miglioramento solo iniziale di UPDRS e della sintomatologia, per poi subire un peggioramento ed una progressione di malattia.
Nello studio di Khan et al. (2011) PPN e cZi DBS (in combinazione) mostrano un miglioramento dei sintomi assiali, della qualità di vita e di UPDRS (parte III). Nello studio di Mestre et al. (2016) con PPN-DBS, non si osservano miglioramenti permanenti a 4 anni, ma comunque 1/3 dei pazienti mostra benefici per le cadute e FOG. Nello studio di Moro et al. (2010) con PPN-DBS il punteggio UPDRS non migliora, ma si osservano comunque dei cambiamenti positivi per le cadute, come dimostrato in seguito da Karachiet al. (2019) con STN-DBS. Anche Sidiropoulos et al. (2013) con STN-DBS ha dimostrato che i miglioramenti dei sintomi possono essere modesti e quindi difficilmente rilevabili con strumenti come UPDRS. In maniera analoga, Welter et al. (2015) mostra come i miglioramenti siano difficili da apprezzare con i test classici, ma che comunque PPN-DBS potrebbe alleviare il FOG e, più generalmente, i deficit di equilibrio. Rocha et al. (2021) nel loro studio dimostrano che FF-DBS avrebbe un potenziale terapeutico nella MP avanzata in presenza di deficit di andatura e di cadute frequenti. In ultimo, nello studio di Bourilhon et al. (2022) non sono state ritrovate differenze significative con o senza PPN/CuN DBS, ed in particolare i disturbi di andatura e di equilibrio non migliorano.
L’interesse infermieristico, a fronte dei risultati riscontrati, dovrebbe orientarsi ad un utilizzo sempre maggiore di strumenti validati per poter evidenziare i prodromi del rischio di caduta. Infatti, anche se DBS riduce tale rischio, mancano ancora degli strumenti che possano identificare con precisione gli eventi o i soggetti maggiormente a rischio.
Purtroppo, dall’analisi delle informazioni raccolte da questa revisione, si è evidenziato che la scala clinica UPDRS non è lo strumento migliore per la valutazione del rischio di caduta in questa tipologia di pazienti.
A questo proposito l’interesse infermieristico dovrebbe considerare l’obiettivo futuro di dover ricercare lo strumento più adatto per tale identificazione.
Per fare ciò, è possibile immaginare di far affidamento su ulteriori scale e test clinici, se usati in combinazione fra loro, come: la parte motoria della UPDRS, specifica per il Parkinson; la BBS ed il test TUG per valutare andatura ed equilibrio; la scala Tinetti relativa al rischio di caduta; il punteggio FES per rilevare il grado di autonomia nelle Personal ADL e IADL e tante altre.
Per la prevenzione del rischio di caduta è inoltre consigliabile prevedere delle attività di educazione sanitaria, in seguito a DBS e sulla gestione del miglioramento dell’autonomia che ne consegue.
Come primo intervento è importante che l’infermiere ricordi al paziente di non sottovalutare mai la malattia, di non sentirsi invincibile, perché non potrà mai guarire davvero. Deve assicurarsi quindi che sappia che il rischio di caduta persiste anche in seguito all’intervento e l’infermiere deve aiutarlo ad adottare tutte le strategie necessarie per poterlo prevenire, rinnovando le sue conoscenze.
Un altro provvedimento utile per garantire la personalizzazione delle cure e per l’identificazione del rischio è quello di consigliare al paziente di prendere nota su quaderno o diario apposito dei vari sintomi, impedimenti e cadute che si verificano in seguito all’intervento (riportando quindi evento e causa scatenante).
Un ultimo spunto può essere dato da una revisione condotta da Lieber, secondo cui nei soggetti sottoposti a DBS con alto rischio di caduta possono essere impiegati gli accelerometri. Sono degli strumenti indossabili in grado di monitorare l’andamento sintomatologico e di fornire le informazioni necessarie riguardo le caratteristiche motorie. Questa nuova tecnologia consentirebbe quindi un monitoraggio continuo e a distanza della sintomatologia motoria, che può poi essere trasmessa direttamente al team di cura.
Questi accelerometri indossabili potrebbero quindi rappresentare un mezzo con cui poter riconoscere e prevedere le cadute (Lieber et al., 2015).
In conclusione, DBS sembrerebbe utile per poter ridurre la sintomatologia motoria ed il rischio di caduta nel Parkinson, ricordando però quanto sia importante la personalizzazione delle cure e dei trattamenti per il singolo paziente. Vista la recente espansione di tali dispositivi, risulta necessario effettuare ulteriori studi per poter confermare quanto risultato da questa ricerca.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi. Gli autori hanno condiviso i contenuti dello studio, la stesura dell’articolo e approvano la versione finale dello stesso.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.






