ABBREVIAZIONI
AIAC – Associazione Italiana Aritmologia e Cardiostimolazione, ANMCO – Associazione Nazionale Medici Cardiologi Ospedalieri, CIED – Cardiac Implantable Electronic Device, CRTD – Cardiac Resynchronization Therapy Defibrillator, CRTP – Cardiac Resynchronization Therapy Pacemaker, ESC – European Society Cardiology, ERI – Elective Replacement Indicator, HF – Heart Failure, HRS – Heart Rhythm Society, HRV – Heart Rate Variability, ICD – Implantable Cardioverter Defibrillator, ICM – Implantable Cardiac Monitor, ILP – Implantable Loop Recorder, IPE – In Person Evaluation, PM – Pacemaker, RCT – Randomized Controlled Trial, RM – Remote Monitoring, RRT – Recommended Replacement Time.
INQUADRAMENTO GENERALE
Negli ultimi anni la popolazione di pazienti che regolarmente accede ai servizi ambulatoriali di controllo periodico del dispositivo cardiaco impiantabile – CIED (PM, ICD, CRTP, CRTD, monitor cardiaci sottocutanei ILP/ICM/Reveal) è letteralmente esplosa con conseguente rilevante incremento del carico di lavoro per i Centri di Aritmologia e Cardiostimolazione. Il follow-up dei pazienti con CIED è parte integrante del processo terapeutico, richiede controlli ambulatoriali cadenzati ed è divenuto oneroso per il numero crescente di pazienti impiantati e per la complessità tecnica dei dispositivi (Ricci e Locati et al, 2015; AIAC e ANMCO, 2020). La frequenza dei controlli, secondo le principali linee guida delle Società Internazionali di Cardiologia, prevede 1 controllo nell’immediato post-impianto, da 1 a 4 controlli annui in relazione al tipo di dispositivo e controlli ravvicinati a cadenza trimestrale per eventuali problemi legati al funzionamento del dispositivo (recall/advisory, nota tecnica delle aziende produttrici) o all’approssimarsi del “fine vita” (AIAC e ANMCO, 2020). Un limite del follow-up tradizionale (controllo in office) è dato dall’acquisizione ritardata delle informazioni diagnostiche memorizzate dal dispositivo che, se acquisite prontamente, possono favorire una reazione clinica tempestiva (Ricci e Locati et al, 2015). Il controllo in office, dato il numero crescente di pazienti impiantati, difficilmente è associato ad una visita clinica e si limita, dunque, alla verifica elettrica del dispositivo (longevità; valori soglia di stimolazione/sensibilità degli elettrocateteri, sia in forma numerica sia grafica, e impedenza degli stessi, indicatore della loro integrità), ricavando le medesime informazioni di un report di un controllo programmato da remoto (Zanotto, 2016). Solo il 6.6% dei controlli in office conduce ad azioni cliniche rilevanti (AIAC e ANMCO, 2020). Ulteriori studi clinici hanno documentato che, nell’80% dei casi, i controlli tradizionali non inducono alcuna azione clinica di riprogrammazione del dispositivo e/o modifica della terapia farmacologica (Ricci e Locati et al, 2015). Il monitoraggio intensivo mediato da controlli in office ravvicinati è oneroso e spesso inefficiente in quanto non è in grado di intercettare eventi clinici potenzialmente avversi che si verificano nell’intervallo fra le visite. Per maggiore chiarezza, è opportuno precisare una distinzione fra (1) controllo remoto (interrogazione remota), che prevede la trasmissione periodica (manuale e automatica) dei parametri elettrici, senza che il paziente sia fisicamente presente, e che può sostituire la visita ambulatoriale cadenzata, e (2) monitoraggio remoto – RM (sorveglianza remota), che include trasmissioni frequenti ad intervalli prefissati e l’invio automatico di allarmi in caso di eventi predefiniti, sia clinici sia strumentali, anch’esso senza la presenza fisica del paziente (Ricci e Locati et al, 2015; Zanotto, 2016). In accordo con il consenso ISHNE/EHRA, il RM dei CIED consiste nella trasmissione automatica non schedulata dei dati sulla base di avvisi prestabiliti relativi al funzionamento del device e ad eventi clinici (Dubner e Auricchio et al, 2012). Tali potenzialità tecnologiche appartengono ai dispositivi dotati di automatismi dedicati (ICD, ILP, CRT-P/D, PM di ultima generazione). Biotronik, Medtronic, Abbott/St. Jude Medical, Boston Scientific e Microport/Sorin Group rappresentano le principali ditte fornitrici di CIED che, negli anni, hanno sviluppato specifici sistemi di RM per i dispositivi di loro produzione. I CIED dispongono di una serie di indicatori (diagnostiche cliniche) gestibili in monitoraggio remoto, quali la percentuale di resincronizzazione effettivamente erogata, la variabilità della frequenza cardiaca (valore HRV), la variabilità degli intervalli RR (valori SDNN e SDANN) (1), le apnee notturne, le alterazioni del tratto ST e onda T, la capacità di movimento del paziente, le aritmie atriali e ventricolari, il burden di fibrillazione atriale e l’impedenza transtoracica, in parte correlata allo stato di congestione polmonare, indicatori di scompenso cardiaco – HF (Ricci e Locati et al, 2015; Zanotto, 2016). Il monitoraggio puntuale e protratto del tratto ST-onda T consente di identificare gli eventuali eventi ischemici, potenziali trigger di aritmie e di evoluzione della disfunzione ventricolare sinistra (Zanotto, 2016). Ne consegue, dunque, una precoce identificazione di eventi clinicamente rilevanti e conseguente riduzione del tempo evento-reazione. Il RM non è un sistema di gestione delle emergenze e in nessun caso prevede la possibilità di riprogrammare il dispositivo (Ricci e Locati et al, 2015). La sorveglianza da remoto migliora significativamente la prognosi dei pazienti e la gestione clinica, senza comprometterne la sicurezza, riducendo tempi e costi; pertanto, può sostituire il controllo ambulatoriale tradizionale, fermo restando almeno 1 controllo in office annuo come raccomandato dalle linee guida internazionali (Ricci e Locati et al, 2015; Slotwiner e Varma et al, 2015). Nel 2015 l’HRS ha pubblicato un Documento di Consenso che ha attribuito al RM dei CIED una Classe di raccomandazione I con livello di evidenza A (Figura 1) (Slotwiner e Varma et al, 2015). In riferimento alle linee guida HRS, l’attività di sorveglianza da remoto dovrebbe essere garantita a tutti i pazienti con dispositivi cardiaci (Slotwiner e Varma et al, 2015; Malanchini e Ferrari et al, 2021).

Figura 1 – Raccomandazioni HRS.
Le linee guida ESC 2021 hanno definito la frequenza dei controlli in office e da remoto dei PM e CRT-P (Figura 2) e le raccomandazioni in merito (Figura 3) (Glikson e Nielsen et al, 2021).
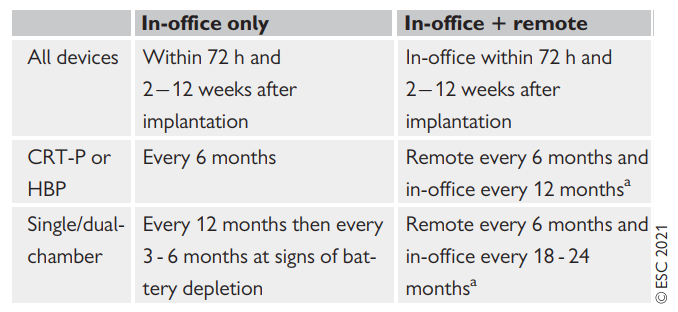
Figura 2 – Frequenza follow-up in office e in controllo remoto.
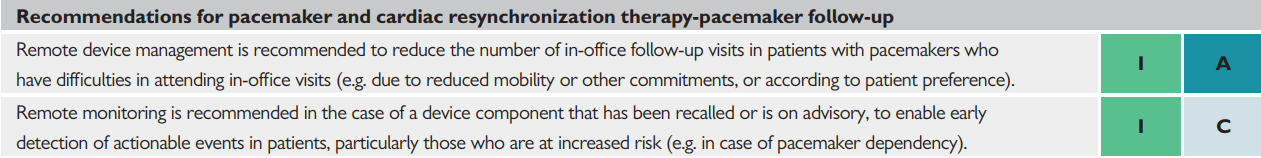
Figura 3 – Raccomandazioni ESC 2021.
I benefici del RM intervengono su più livelli, economico, sociale e clinico. Studi clinici hanno documentato chiari vantaggi per il paziente (riduzione del 66,4% delle spese connesse alla visita), per i familiari (riduzione del 70.4% del valore monetario delle ore di lavoro perse), per il sistema sanitario (riduzione del 54% del costo annuo per paziente) e per gli operatori sanitari (riduzione del 60% delle visite ambulatoriali non necessarie con possibilità di reimpiego in altre attività) (AIAC e ANMCO, 2020). È emersa una riduzione del 50% del numero di visite ambulatoriali, una riduzione della durata del singolo follow-up (tempo medico e infermieristico: 4-8 minuti vs 26 minuti del controllo tradizionale), una precoce identificazione dei malfunzionamenti, un’efficace gestione dei recall, una riduzione dei costi indiretti della mancata produttività per le giornate lavorative retribuite perse dal paziente e dal caregiver, una migliore qualità di vita, compliance e soddisfazione del paziente (Ricci e Locati et al, 2015). La letteratura documenta una riduzione del numero e della durata delle ospedalizzazioni e una riduzione del numero di accessi al Dipartimento di Emergenza per condizioni di esacerbazione clinica (Taylor e Thomas et al, 2021). È stata dimostrata una riduzione del rischio assoluto di mortalità per tutte le cause e dell’endpoint combinato “mortalità per tutte le cause e ospedalizzazione per scompenso cardiaco” nei pazienti seguiti in RM rispetto ai pazienti seguiti solo ambulatorialmente (Hindricks e Varma et al, 2017). È stata dimostrata una sensibilità dell’84.3% nell’identificazione di eventi avversi, clinici o legati al dispositivo, con un potere predittivo positivo del 97.4%. Inoltre, il RM ha permesso la diagnosi del 95% degli eventi asintomatici e del 73% di eventi che hanno richiesto un’azione correttiva (Ricci e Morichelli et al, 2013). L’affidabilità degli algoritmi predittivi di scompenso è stata validata da diversi studi. La valutazione combinata di indicatori clinici di scompenso rilevati in RM ha consentito di prevedere un peggioramento clinico fino a 30-55 giorni prima dell’evento clinico acuto (AIAC e ANMCO, 2020). Il monitoraggio remoto consente una diagnosi precoce di insorgenza di aritmie. Il tempo di intervento è risultato inferiore del 44% ed il burden di aritmie atriali è risultato inferiore del 18%, con una riduzione dell’associato rischio di stroke tra il 9 ed il 18% rispetto al controllo ambulatoriale (AIAC e ANMCO, 2020). La gestione tradizionale dei device che si avvicinano al “fine vita” per naturale esaurimento richiede una progressiva riduzione degli intervalli di follow-up per identificare il momento di sostituzione elettiva. Spesso, la sostituzione viene effettuata in anticipo rispetto al raggiungimento dell’indicatore di fine vita (ERI). Il RM consente di effettuare la sostituzione in assoluta sicurezza solo al raggiungimento dell’ERI, con evidenti benefici economici. Nella fattispecie, il RM ha determinato un allungamento della longevità dei dispositivi di 11 mesi (Ricci e Morichelli et al, 2015).
La figura 4, estratta fedelmente dal Current Cardiology Reports Journal, sintetizza i dati estrapolati da RCT che confrontano, in termini di mortalità, ospedalizzazione e altri potenziali benefici, il RM rispetto al solo follow-up in office nei pazienti con HF impiantati con CIED (Imberti e Tosetti et al, 2021).
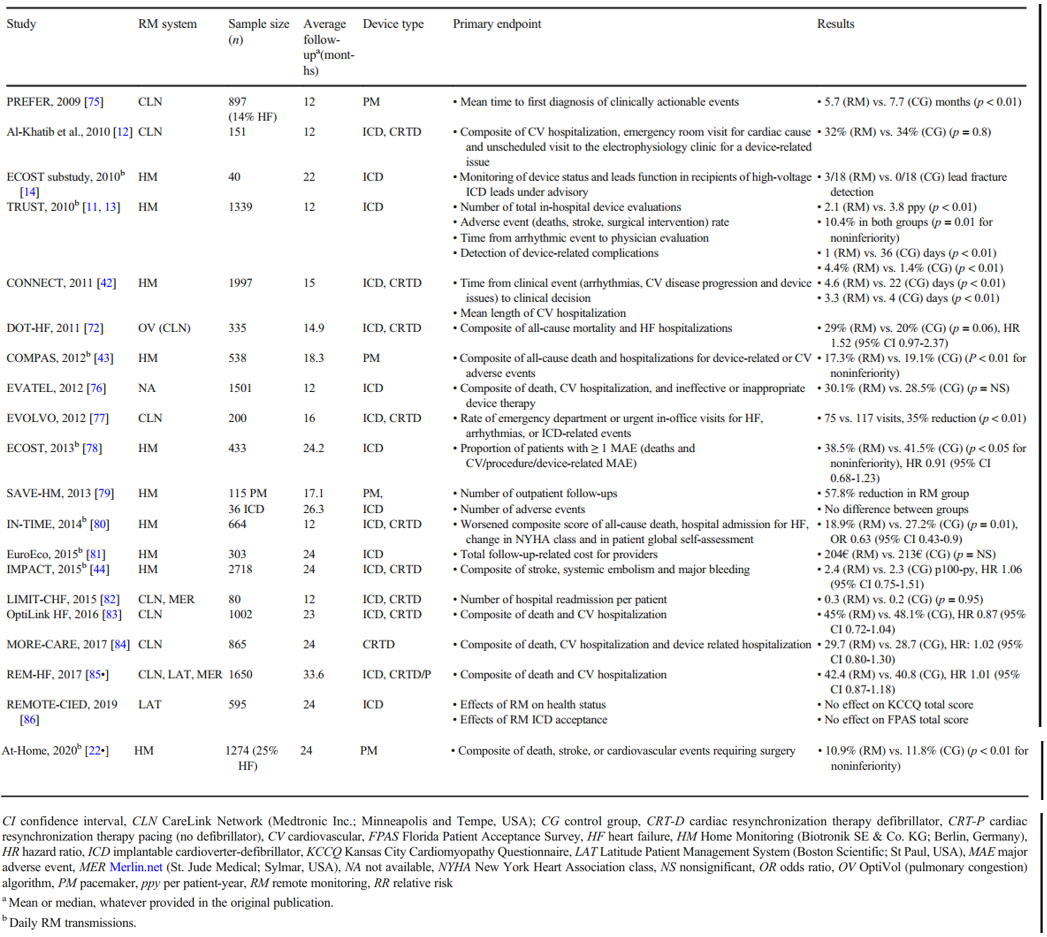
Figura 4 – Follow-up in RM vs follow-up in office.
L’impatto economico è favorevole sia nella prospettiva del paziente sia del terzo pagante e parzialmente per l’erogatore del servizio in assenza di un rimborso delle prestazioni (Ricci e Locati et al, 2015). A tal proposito, il riconoscimento amministrativo e il rimborso del RM dei dispositivi impiantabili, a lungo promosso da AIAC nelle varie sedi istituzionali e supportato da analisi favorevoli di Health Technology Assessment, sta acquistando terreno fertile in Italia. L’emergenza COVID, con il consolidamento della telemedicina in sanità per ridurre gli accessi alle strutture sanitarie e rafforzare le cure domiciliari, ha potenziato un percorso avviato da oltre 10 anni. La Regione Toscana ha ufficializzato il riconoscimento delle prestazioni con la Delibera 464 del 06.04.2020, che sollecita la riprogrammazione delle attività ambulatoriali, l’utilizzo e il potenziamento delle tecnologie della sanità digitale (e-Health), perlopiù il ricorso alla Telemedicina e Teleassistenza. In tale ottica, il consolidamento del monitoraggio remoto costituisce una fisiologica risposta alle esigenze di sicurezza ed efficacia della prestazione ambulatoriale di controllo dei pazienti portatori di device nonché di rispetto delle norme di contenimento alla diffusione del virus SARS-COV-2 (AIAC e ANMCO, 2020). Il modello di rimborso suggerito per il Servizio di Monitoraggio Remoto si basa sulla riallocazione delle risorse inizialmente destinate ai controlli ambulatoriali al fine di garantirne la sostenibilità (AIAC e ANMCO, 2020). L’introduzione del RM nella pratica clinica richiede l’implementazione di modelli organizzativi strutturati che armonizzino e codifichino ruoli e responsabilità all’interno di un network centrato sul paziente (Ricci e Locati et al, 2015).
CONTESTO
In Fondazione Toscana Gabriele Monasterio – FTGM, presso l’U.O.S.V.D. Elettrofisiologia Interventistica dell’Ospedale San Cataldo di Pisa, il RM dei CIED è attivo dal 2014. Il processo di consolidamento è stato complesso, mediato da attività di sviluppo (pianificazione/gestione organizzativa) e formazione. In Azienda vengono impiantati i CIED di cinque ditte produttrici (Biotronik, Medtronic, Abbott/St. Jude Medical, Boston Scientific e Microport/Sorin Group), ciascuna delle quali possiede una propria interfaccia web che restituisce al personale preposto i dati trasmessi dai dispositivi e decriptati da un server centrale. Il processo di implementazione ha preso il via nel dicembre 2014 con la ditta Medtronic, a cui si sono aggiunte le restanti ditte di cui sopra entro maggio 2015. Tutti i dispositivi in RM prevedono che il paziente, opportunamente informato sull’utilizzo e funzionalità, abbia in dotazione un monitor/trasmettitore, consegnato dal personale medico-infermieristico autorizzato o dall’ingegnere della ditta fornitrice, deputato ad interrogare il device impiantato, trasmettendo i dati in memoria, manuali o automatici, tramite la rete telefonica mobile o fissa, ad un server centrale che li decripta e li rende disponibili su un sito web dedicato, accessibile mediante login dal personale sanitario preposto a tale attività. Il paziente, fruitore del servizio, si impegna ad assicurare il collegamento del trasmettitore alla rete elettrica, a notificare tempestivamente eventuali problemi tecnici, a fornire un recapito telefonico e l’eventuale variazione nonché a comunicare un eventuale allontanamento dal trasmettitore per oltre 8 giorni. L’acquisizione del consenso informato, previa consegna dell’informativa, è una conditio sine qua non per l’avvio della sorveglianza da remoto. Nella sezione intranet aziendale sono depositati l’informativa, il consenso informato e l’istruzione operativa in merito. Il modello organizzativo in essere prevede l’assegnazione di due infermieri, esperti in Elettrofisiologia e Cardiostimolazione, referenti per ciascuna ditta e un cardiologo elettrofisiologo referente per la valutazione dei dati tecnici e clinici trasmessi. L’infermiere referente è responsabile di: educazione e addestramento del paziente, verifica della regolarità del flusso delle trasmissioni, screening preliminare con identificazione dei casi critici da sottomettere al medico referente, contatto con il paziente per monitorarne compliance e benefici. Il medico referente è responsabile della sottomissione del consenso informato, supervisione e analisi delle trasmissioni, gestione clinica dei problemi emergenti, rapporti con il medico di medicina generale e altri specialisti clinici (Ambulatorio Aritmie e Canalopatie/Ambulatorio Scompenso cardiaco avanzato).
La figura 5 illustra i fattori, interni ed esterni, influenti sul processo di consolidamento del RM.
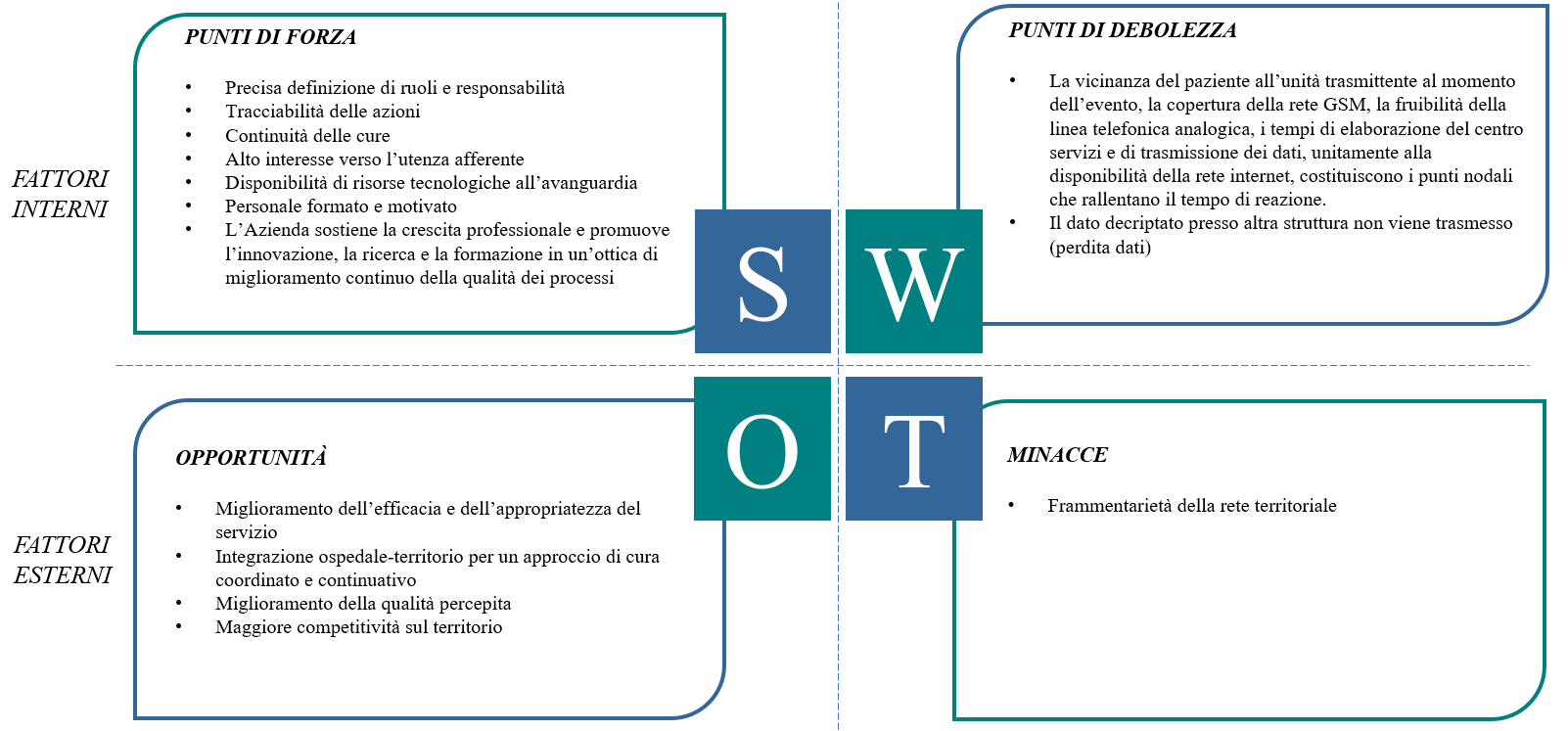
Figura 5 – Analisi SWOT.
È previsto un controllo periodico di verifica degli accessi effettuati dal personale sui diversi siti dedicati. Il tipo e la frequenza delle trasmissioni ad intervalli prefissati dipendono esclusivamente dalle condizioni cliniche del paziente e dalla tipologia di sistema in dotazione. L’interrogazione da remoto a intervalli prefissati è prevista a cadenza trimestrale. Le informazioni acquisite da remoto vengono utilizzate come supporto ad eventuali variazioni della terapia farmacologica, per ottimizzare i controlli in office di riprogrammazione del device e per migliorare la gestione clinica del paziente. In caso di anomalie di funzionamento del dispositivo o di predefiniti eventi clinici, il sistema invia al sito web un messaggio di allarme (Alert) contraddistinto da un segnale a colori di tipo semaforico (figura 6, figura 7).

Figura 6 – Allarmi rossi – Eventi critici.

Figura 7 – Allarmi gialli – Eventi significativi.
Gli allarmi sono verificabili sul sito dedicato e ogni ditta ha una modalità differenziata di notifica al referente (via mail o fax). Per i monitor disconnessi o non configurati non sono previsti allarmi codificati. L’interruzione delle trasmissioni viene notificata con tempi differenti in relazione alla ditta. La valutazione dei pazienti disconnessi avviene mediamente ogni 15 giorni. Alla trasmissione dell’informazione di interruzione segue il contatto telefonico entro 72 ore. Se non fosse possibile accertarsi telefonicamente dell’integrità del sistema di trasmissione, il paziente viene convocato per una visita aggiuntiva e l’eventuale sostituzione dell’unità trasmittente. In caso di decesso o interruzione volontaria di utilizzo, l’informativa debitamente fornita al paziente declina le modalità di consegna del monitor in FTGM. Sono stati definiti algoritmi decisionali condivisi, aggiornati nel corso degli anni, finalizzati alla codifica di tempi e modalità di risposta agli allarmi di cui sopra (Figure 8-11).
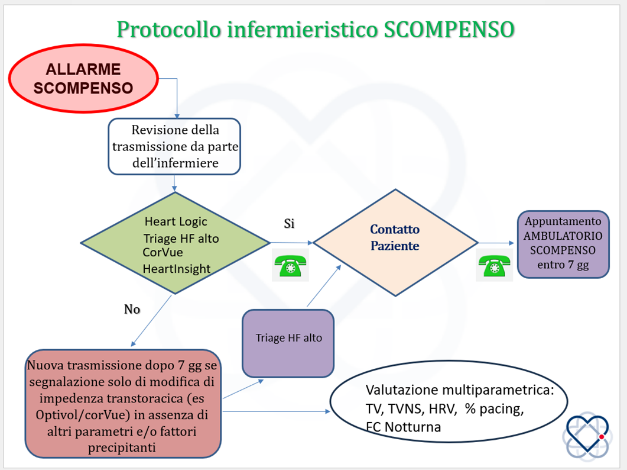
Figura 8 – Protocollo infermieristico – Scompenso.
HeartLogic: algoritmo multisensore implementabile nei dispositivi CRT-D e ICD di Boston Scientific: Funziona integrando 5 parametri associati ad altrettanti aspetti patofisiologici dello scompenso cardiaco, quali toni cardiaci, impedenza toracica, respirazione, frequenza cardiaca e livello di attività.
Triage HF: è uno strumento, elaborato dalla Medtronic, di valutazione del rischio di insufficienza cardiaca semplificato e integrato che notifica i cambiamenti clinicamente rilevanti.
CoreVue: sistema di monitoraggio dell’impedenza transtoracica multivettoriale di Abbott/S.Jude Medical
OPTIVOL: indice di accumulo di fluidi a cui è associata l’impedenza transtoracia; ad una riduzione significativa dell’impedenza corrisponde un incremento dell’indice OPTIVOL.
HeartInsight: è uno strumento di Biotronik per il monitoraggio e notifica dell’insufficienza cardiaca.
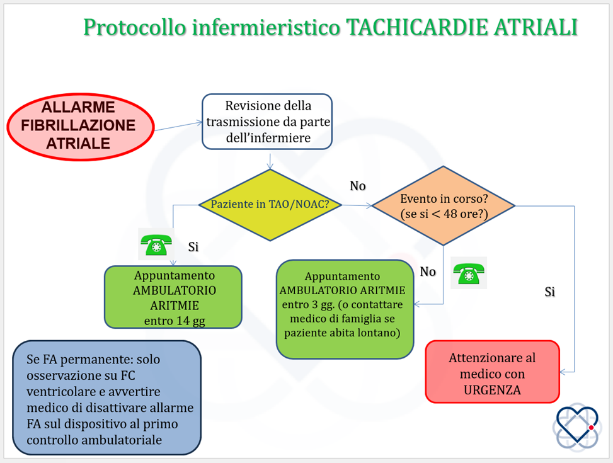
Figura 9 – Protocollo infermieristico – Tachicardie atriali.
TAO: Terapia Anticoagulante Orale
NOAC: Nuovi Anticoagulanti Orali
FA: Fibrillazione Atriale
FC: Frequenza cardiaca
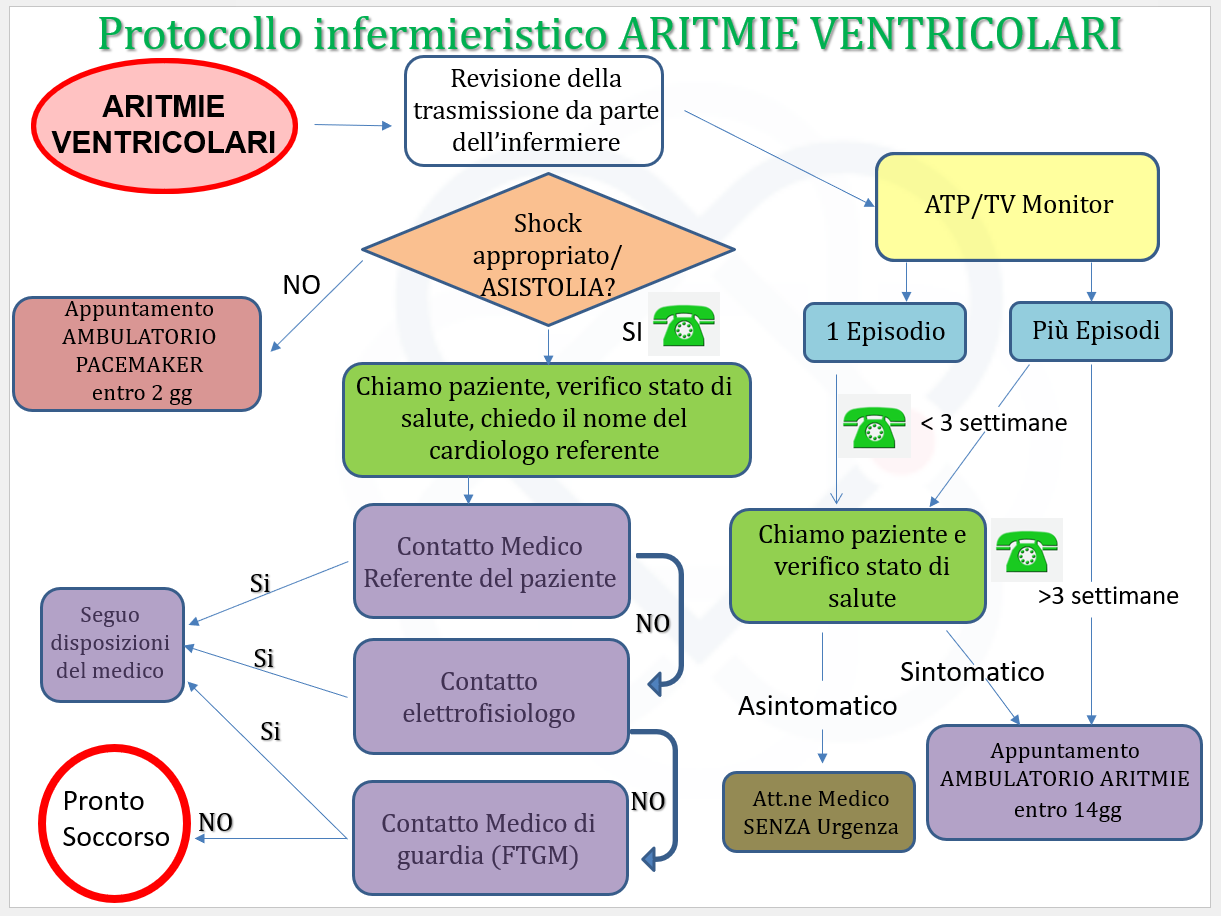
Figura 10 – Protocollo infermieristico – Aritimie ventricolari.
ATP: Pacing antitachicardico
TV: Tachicardia Ventricolare
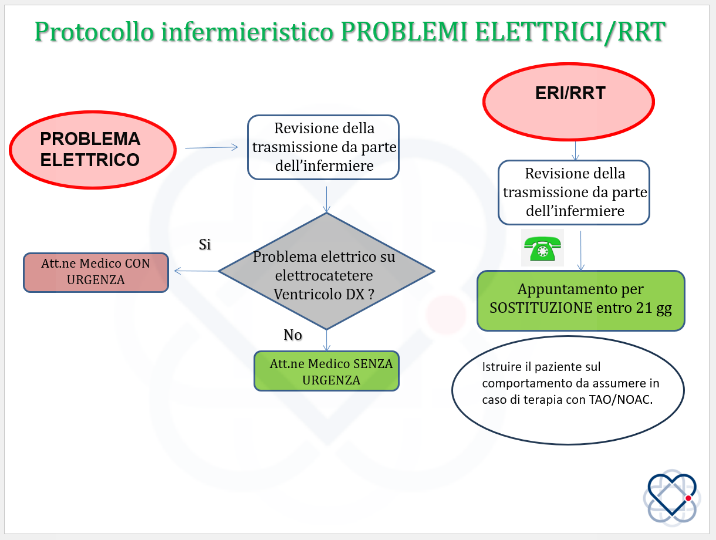
Figura 11 – Protocollo infermieristico – Problemi elettrici/RRT
RRT: Recommended Replacement Time
TAO: Terapia Anticoagulante Orale
NOAC: Nuovi Anticoagulanti Orali
Per ciascuna ditta è stato definito un timing per la ricezione delle trasmissioni pianificate. L’ingegnere dell’azienda fornitrice provvede all’accoppiamento del monitor/paziente sul sito web dedicato e definisce i follow-up delle trasmissioni automatiche in relazione al timing aziendale. Al termine della procedura ed entro la data di dimissione, l’ingegnere e il cardiologo elettrofisiologo provvedono alla programmazione del device e alla configurazione degli allarmi sul sito. Dal lunedì al sabato, l’infermiere designato in programmazione oraria dal coordinatore infermieristico, dalle ore 7.30 fino all’inizio dell’attività di sala, si dedica all’analisi degli allarmi rossi. In conformità ai diversi protocolli, egli sottopone i casi critici al medico referente per la valutazione clinica. Gli allarmi gialli e le restanti trasmissioni vengono analizzate quotidianamente al termine delle attività. Al paziente viene fornito il recapito e l’indirizzo e-mail del personale sanitario autorizzato da contattare per qualsiasi chiarimento sul servizio di monitoraggio remoto, sul sistema di trasmissione dei dati e per eventuali comunicazioni. Vengono altresì forniti i contatti del servizio di assistenza tecnica della ditta produttrice nel caso in cui riscontrasse problemi tecnici nell’utilizzo del sistema. Previa comunicazione scritta con preavviso non inferiore ad 1 mese, l’Azienda può riservarsi di interrompere il servizio. Parimenti il paziente ha la facoltà di recedere in qualsiasi momento con effetto immediato previa comunicazione scritta. In assenza di disposizioni, la partecipazione si intende tacitamente rinnovata senza limiti di tempo. Il servizio di sorveglianza remota, come chiaramente definito in letteratura, non è un sistema di emergenza. In caso di insorgenza di disturbi clinici gravi e/o eventi aritmici, il paziente deve ricorrere alla rete di gestione delle emergenze (118, Pronto Soccorso).
OBIETTIVI
L’attività di RM in FTGM nasce con l’obiettivo primario di assicurare ai pazienti con CIED equità, continuità e sicurezza delle cure, potenziando l’assistenza personalizzata e il processo decisionale condiviso, in conformità con quanto richiesto dalle Linee di Indirizzo Nazionali per la Telemedicina. I pazienti portatori di CIED sono giudicati a rischio di deterioramento clinico, con un grado di compromissione più o meno elevato in relazione alla patologia cardiaca di base. Il RM in FTGM nasce come fisiologica risposta alle esigenze di cura dei pazienti impiantati. Lo sforzo congiunto della Fondazione ha mirato alla riconversione in remoto della quasi totalità dei CIED. Il sistema organizzativo aziendale, a fronte di un incremento progressivo di impianti, ha richiesto una decongestione delle attività ambulatoriali non necessarie, ridefinendo l’allocazione delle risorse per la gestione dei pazienti più compromessi e, al tempo stesso, potenziando l’efficienza della prestazione con chiari benefici clinici, quali la diagnosi precoce di eventi di instabilità clinica, garantendo una riduzione del tempo evento-reazione tale da contenere le ospedalizzazioni e le complicanze maggiori (risposta anticipata alla fase avanzata di eventi clinici rilevanti).
RISULTATI
Come anticipato nella sezione Contesto, la Fondazione è impegnata nell’attività di RM dal 2014. Il tasso di pazienti fruitori ha subito negli anni un progressivo incremento. La sorveglianza da remoto ha subito un’ulteriore spinta durante l’emergenza SARS-COV 2, garantendo una risposta efficace alle esigenze di cura dei pazienti impiantati e, nel contempo, una risposta sicura, limitando il rischio di contagio. L’attività di sorveglianza ha migliorato il workflow clinico-assistenziale, ha assicurato una gestione integrata ospedale-territorio, ottimizzando le risorse economiche, umane e strutturali. Nel 2014 i CIED in RM erano esattamente 250. Ad oggi i pazienti con CIED gestiti presso FTGM e arruolati in RM sono 1810 (100% ICD, CRT-P/D e Reveal); per quanto attiene i PM in RM i criteri di inclusione sono legati alla (1) logistica, (2) criticità clinica e (3) recall/advisory. A partire da dicembre 2023 tutti i PM saranno arruolati in RM.
Il grafico 1 illustra la distribuzione dei CIED in RM caratterizzati per tipologia.
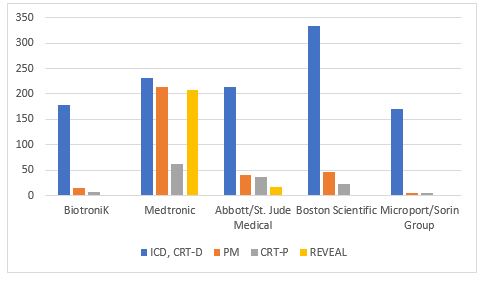
Grafico 1 – Distribuzione CIED in RM.
L’aderenza dei pazienti al RM è del 100%. Solo una minoranza (<5%), a distanza di circa 6 mesi, ne sospende l’adesione. Le motivazioni che sottendono al rifiuto perlopiù includono il diniego della tecnologia e il timore di perdere il contatto umano con medici e infermieri. Per i dispositivi non gestiti in RM il calendario dei controlli in office prevede 3 controlli annui per ICD e CRT-P/D (1-6-12 mesi) e 2 controlli annui per PM (1-12 mesi), a cui si aggiungono i controlli ravvicinati per “fine vita”. Per i CIED in RM, nel primo anno post-impianto sono previsti 2 controlli in office per ICD, PM e CRT-P/D (1-12 mesi). A partire dal secondo anno, i controlli ambulatoriali si riducono a 1 annuo sia per ICD e dispositivi di resincronizzazione cardiaca (12 mesi) sia per PM (18 mesi).
Per quanto attiene la formazione, il personale infermieristico è attivamente coinvolto in attività di aggiornamento continuo. Il percorso ha richiesto fasi incrementali di sviluppo, a partire da settembre 2014, di pari passo all’integrazione delle varie piattaforme web (Figura 12). Sono previsti corsi di formazione periodica (1 annuo) e ulteriori corsi di aggiornamento, se richiesti dalle ditte fornitrici di CIED, con rilascio di attestato di partecipazione.
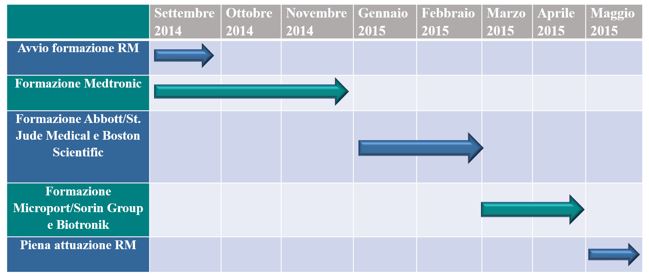
Figura 12 – Formazione RM – diagramma di Gantt.
Il personale identifica i propri bisogni formativi, segue i corsi obbligatori aziendali, i corsi di formazione specifica correlati al proprio ambito, sia interni sia promossi da altri Provider, partecipa alle riunioni periodiche di Unità Operativa, per il miglioramento organizzativo e assistenziale, svolge funzione di tutor per gli studenti universitari e per i colleghi neoassunti. Le competenze relazionali, tecniche, specialistiche e organizzative sono chiaramente definite dalla Job Description del profilo di appartenenza. L’Azienda ha definito un piano di orientamento e di inserimento del neoassunto con valutazioni cadenzate ad una settimana, a due mesi e, successivamente, al termine del quarto e del sesto mese. Terminato il semestre, il neoassunto viene inserito nel percorso di formazione RM.
CONCLUSIONI
Nel panorama nazionale, il progressivo aumento dei pazienti con CIED ha determinato un incremento dei follow-up, eccedendo l’offerta ambulatoriale con conseguente impegno suppletivo, non sostenibile, di risorse umane ed economiche. La sorveglianza da remoto è una necessità clinica e sociale non più eludibile. Il tele-monitoraggio, standard of care nel follow-up dei pazienti con CIED, offre un modello di community-care che prevede un coordinamento ospedale-territorio tale da garantire una gestione integrata continuativa del paziente e la ripresa di un Sistema Sanitario ormai congestionato. I modelli e-Health della sanità digitale coinvolgono in toto i pazienti, che assumono un ruolo attivo nel proprio percorso di cura, e tale approccio personalizzato, incluso il processo decisionale condiviso, è di estrema rilevanza. In un’ottica di efficienza, il recupero di risorse consente una più ampia ed efficace presa in carico dei pazienti cronici e/o fragili, riducendo gli accessi non necessari e dando spazio a valutazioni più complesse e di maggiore valore clinico. Per i prossimi anni la Fondazione si impegna a (1) rafforzare la rete di collaborazione tra il team CIED e gli specialisti clinici per una gestione maggiormente integrata dei pazienti e (2) garantire al personale preposto una migliore accessibilità e archiviazione dei dati sulle piattaforme web dedicate. Nell’ottica di una rete virtuale maggiormente interattiva, è in fase di attuazione (1) la condivisione dei referti RM con il paziente, il medico specialista clinico di riferimento e il medico di medicina generale e (2) l’implementazione di un’applicazione mobile aggiuntiva al monitor/unità trasmittente.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi. Gli autori hanno condiviso i contenuti dello studio, la stesura dell’articolo e approvano la versione finale dello stesso.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.
Ringraziamenti
Gli autori ringraziano tutti il team CIED, l’U.O.S.V.D. Elettrofisiologia Interventistica e la Direzione Aziendale per l’implementazione e il consolidamento dell’attività RM e per l’impegno quotidianamente profuso.