INTRODUZIONE
L’epilessia è un disordine cerebrale cronico caratterizzato dalla ricorrenza di crisi epilettiche di durata in genere da secondi a pochi minuti. Queste possono manifestarsi con crisi parziali o generalizzate che coinvolgono l’intero corpo e generano perdita di coscienza e, a volte, il mancato controllo degli sfinteri (ISSalute, 2019). Le crisi epilettiche possono variare in base a frequenza, caratteristiche cliniche, intensità e durata (ISSalute, 2019). A livello globale circa 50 milioni di persone convivono con l’epilessia (WHO, 2022). Nei Paesi ad alto reddito la prevalenza di epilessia attiva (presenza di convulsioni permanenti con necessità di cure) è di 4-10 casi ogni 1000 persone; nei Paesi a basso e medio reddito, dove vive circa l’80% dei soggetti colpiti da epilessia, il problema interesserebbe 7-14 persone su 1000 (ISSalute, 2019). Nei Paesi ad alto reddito i nuovi casi annuali sono 30-50 ogni 100000 persone, in quelli a basso e medio reddito questa cifra può essere anche doppia (ISSalute, 2019). L’epilessia può esordire a tutte le età ma i picchi d’incidenza si hanno nei bambini e negli anziani; si stima che in Italia ne siano affette 500000-600000 persone (SIN, 2022). Fino al 70% delle persone colpite da epilessia che possono beneficiare di farmaci antiepilettici vedono scomparire le crisi o almeno assistono ad una diminuzione della frequenza e intensità (ISSalute, 2019). La terapia deve essere gestita da clinici esperti perché non può essere avviata o interrotta senza ragionevoli motivazioni (ISSalute, 2019).
L’interruzione della terapia antiepilettica può essere presa in considerazione dopo due anni senza convulsioni (WHO, 2022). Oltre alla stretta aderenza al regime farmacologico prescritto le persone con epilessia dovrebbero adottare i seguenti comportamenti: 1) dormire a sufficienza, in quanto la mancanza di sonno può provocare convulsioni; 2) fare esercizio fisico, per mantenersi in forma e ridurre la depressione, assicurandosi di idratarsi a sufficienza e di riposare dopo l’allenamento; 3) limitare il consumo di bevande alcoliche e smettere di fumare (ISSalute, 2019). La gestione dell’epilessia, come per altre malattie croniche, attualmente si basa quasi totalmente sulle visite ambulatoriali, durante le quali i medici istruiscono e consigliano regolarmente le persone sulla malattia e i problemi di salute ad essa correlati; tuttavia, costoro trascorrono quasi tutto il loro tempo fuori dall’ambulatorio o dallo studio medico. Questo fa sì che non sia possibile su base giornaliera supportarne e monitorarne l’aderenza al trattamento, l’umore o migliorarne i comportamenti salutari, le capacità di coping e la qualità della vita (Helmers et al., 2017).
L’introduzione di programmi di supporto all’autogestione della malattia può contribuire a colmare questa lacuna, in quanto essi mirano ad aumentare le capacità e la fiducia della persona con epilessia nel monitoraggio dei sintomi, nella risoluzione dei problemi, nel processo decisionale, nella definizione degli obiettivi, nella comunicazione e nell’adozione di comportamenti salutari per il miglioramento della propria salute e qualità della vita (Smithson et al., 2013). Per autogestione si intende “la capacità di affrontare tutto ciò che una malattia cronica comporta, inclusi sintomi, trattamenti, conseguenze fisiche e sociali e cambiamenti nello stile di vita” (Coleman et al., 2005). La rapida evoluzione negli ultimi decenni della tecnologia può offrire nuove opportunità di progettazione ed erogazione di programmi di autogestione per le persone con malattie croniche. Di particolare interesse è l’uso per questo scopo di dispositivi di comunicazione mobile come gli smartphone, ormai ampiamente diffusi. A livello globale, circa il 16,7% di tutti gli abbonamenti di telefonia mobile corrisponde ad abbonamenti per smartphone (Global Mobile Statistics, 2014); in Italia risultano esserci più smartphone che abitanti (ANSA, 2020). Il calo dei prezzi al dettaglio probabilmente contribuirà ad aumentare la diffusione di questi dispositivi anche nei Paesi a medio reddito (Ofcom, 2013). Le sofisticate funzionalità di elaborazione degli smartphone consente di supportare le funzioni di autogestione e di fornirle a livello di popolazione; inoltre possono promuovere interventi di autogestione tramite applicazioni (o “app”), cioè estensioni software personalizzabili, gratuite o a basso costo e facilmente accessibili da aggiungere ai dispositivi (Marcano Belisario et al., 2013). Le app possono supportare l’autogestione in relazione alle potenzialità di indurre cambiamenti nei comportamenti per portare ai risultati attesi. Per l’epilessia questi includono l’automonitoraggio e la risposta alle crisi convulsive, l’evitamento dei fattori scatenanti, la gestione del trattamento, l’aderenza alla terapia antiepilettica e il supporto alla raccolta e al trasferimento a un operatore sanitario di dati in tempo reale (Alzamanan et al., 2021; Marcano Belisario et al., 2013). Sfruttando opzioni video o animazioni, le app possono essere più accessibili anche a persone analfabete o con difficoltà di apprendimento (Marcano Belisario et al., 2013). Sebbene non vi sia ancora una loro sistematica implementazione (Helmers et al., 2017), i programmi di autogestione dell’epilessia sembrano dimostrare un effetto benefico sugli esiti attesi (Bradley et al., 2016). Inoltre, nonostante la presenza sul mercato digitale di diverse applicazioni per smartphone per l’epilessia, l’evidenza della loro efficacia per l’autogestione della malattia non è nota (Escoffery et al., 2018).
OBIETTIVO
Valutare l’efficacia delle app per smartphone per l’autogestione dell’epilessia.
METODI
Per rispondere all’obiettivo è stata implementata una revisione sistematica nel rispetto della checklist PRISMA (Page et al., 2021).
Criteri di ammissibilità
Sono state prese in considerazione sperimentazioni cliniche randomizzate controllate (RCT) centrate sull’utilizzo di un’applicazione (app) per smartphone per l’autogestione dell’epilessia. I criteri di inclusione sono stati i seguenti: 1) Partecipanti – soggetti di qualunque età e sesso con diagnosi di epilessia in qualsiasi ambiente di cura. Sono state escluse persone affette da disturbi neurocognitivi; 2) Intervento – app sanitaria accessibile tramite smartphone finalizzata a sostenere e sviluppare l’autogestione dell’epilessia. Sono stati inclusi studi in cui l’app è stato l’unico mezzo con cui l’intervento è stato erogato o ha rappresentato una parte di un intervento composito. Sono stati esclusi studi che hanno previsto l’utilizzo di un’app a) non focalizzata sull’autogestione della malattia, b) rivolta ad operatori sanitari, c) che si affida esclusivamente a servizi di messaggistica breve (SMS) o multimediale (MMS), d) che non offre una modalità di interazione ma agisce essenzialmente come strumento di trasmissione di dati; 3) Controllo – cure standard (generalmente visite ambulatoriali); 4) Outcome – a) primari: frequenza delle crisi convulsive, capacità di autogestione della malattia misurata con qualsiasi tipo di scala o strumento validato; b) secondari: aderenza al regime terapeutico, qualità di vita percepita, misurati con qualsiasi tipo di scala o strumento validato.
Fonti di informazione e strategia di ricerca
Il protocollo per questa revisione è stato registrato su PROSPERO (ID: CRD42022303763). È stata effettuata una ricerca sistematica della letteratura nei database elettronici Cochrane Library, MEDLINE (via PubMed), EMBASE (via Elsevier), CINAHL (via EBSCOhost), PsycINFO (via Ovid), Web of Science (via Clarivate Analytics), Scopus (via Elsevier). Sono stati consultati inoltre i database Emcare (via Ovid), LILACS (via Virtual Medical Library), ERIC (via ProQuest) e sciELO. Per il reperimento di letteratura grigia sono stati interrogati i motori di ricerca Bielefeld Academic Search Engine, Dissertations & Theses (via ProQuest), Google Scholar, TRIP Medical Database e i siti web Grey Guide, Grey Literature Report, Open Grey, Grey Literature in the Health Sciences. Per verificare l’esistenza di altri RCT di interesse appena completati ma ancora non pubblicati, indicizzati o disponibili online sono stati interrogati i seguenti registri di trial: ICTRP (International Clinical Trials Registry Platform – Organizzazione Mondiale della Sanità), ClinicalTrials.gov (U.S. National Library of Medicine), EU Clinical Trials Register (European Medicines Agency), ISRCTN (International Standard Randomised Controlled Trial Number) registry. È stata inoltre eseguita una ricerca manuale sulle riviste che hanno pubblicato gli studi eleggibili e di questi sono state analizzate le bibliografie. I termini chiave includevano “mobile application”, “cell phone”, “epilepsy”, self-management e i relativi sinonimi. Non sono stati imposti limiti di lingua o data di pubblicazione. Sono state implementate query di diversa complessità in funzione delle caratteristiche proprie della risorsa elettronica interrogata (Tabella 1 e Tabella 2)
| Database | Stringa di ricerca | ||||||||
| Cochrane Library, MEDLINE, EMBASE, CINAHL, PsycINFO, Web of Science, Scopus | #1 app | AND | #16 “cellular phone” | AND | #36 manag* | AND | #40 epilep* | AND | #45 “randomized controlled trial” |
| #2 application* | # 17 “cellular phones” | #37 self-management | #41 seizure* | #46 “randomised controlled trial” | |||||
| # 3 “mobile application” | #18 “cellular telephone” | #38 “self management” | #42 convulsion* | #47 “randomized controlled study” | |||||
| # 4 “mobile applications” | #19 “cellular telephones” | #39
#36 OR #37 OR #38 |
#43 aura* | #48 “randomised controlled study” | |||||
| # 5 “mobile app” | #20 “cell phone” | #44
#40 OR #41 OR #42 OR #43 |
#49 rct | ||||||
| # 6 “mobile apps” | #21 “cell phones” | #50
#45 OR #46 OR #47 OR #48 OR #49 |
|||||||
| #7 “portable electronic app” | #22 “portable cellular phone” | ||||||||
| # 8 “portable electronic apps” | #23 “portable cellular phones” | ||||||||
| # 9 “portable electronic application” | #24 “transportable cellular phone” | ||||||||
| #10 “portable electronic applications” | #25 “transportable cellular phones” | ||||||||
| #11 “portable software app” | #26 “mobile phone” | ||||||||
| #12 “portable software apps” | #27 “mobile phones” | ||||||||
| #13 “portable software application” | #28 “mobile telephone” | ||||||||
| #14 “portable software applications” | #29 “mobile telephones” | ||||||||
| # 15
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9 OR #10 OR #11 OR #12 OR #13 OR #14 |
#30 “car phone” | ||||||||
| #31 “car phones” | |||||||||
| #32 “smart phone” | |||||||||
| #33 “smart phones” | |||||||||
| #34 smartphone* | |||||||||
| #35
#16 OR #17 OR #18 OR #19 OR #20 OR #21 OR #22 OR #23 OR #24 OR #25 OR #26 OR #27 OR #28 OR #29 OR #30 OR #31 OR #32 OR #33 OR #34 |
|||||||||
Tabella 1. – Strategia di ricerca.
| Fonte | Tipo | Stringa di ricerca |
| Emcare | Database | epilepsy AND smartphone |
| ERIC | Database | |
| LILACS | Database | |
| sciELO | Database | |
| Bielefeld Academic Search Engine | Motore di ricerca | epilep* AND smartphone AND (self-management OR “self management”) |
| Dissertations & Theses | Motore di ricerca | epilepsy AND smartphone AND self-management AND rct |
| Google Scholar | Motore di ricerca | “quality of life” AND adult* AND “randomized controlled trial” AND (self-management OR “self management”) AND smartphone AND (epilep* OR seizure* OR convulsion* OR aura*) AND (app OR application* OR “mobile application” OR “mobile app”) |
| TRIP Medical Database (only RCTs) | Motore di ricerca | epilepsy AND adult* AND (self-management OR “self management”) |
| Grey Guide | Sito web | epilepsy AND smartphone |
| Grey Literature in the Health Sciences | Sito web | |
| Grey Literature Report | Sito web | |
| Open Grey | Sito web | |
| ClinicalTrials.gov | Registro di RCT | |
| International Clinical Trials Registry Platform | Registro di RCT | |
| EU Clinical Trials Register | Registro di RCT | |
| ISRCTN registry | Registro di RCT |
Tabella 2. – Strategia di ricerca (segue).
Selezione degli studi ed estrazione dei dati
In modo indipendente è stata effettuata dagli autori la ricerca dei record, lo screening in base alla lettura di titolo e abstract e quello dopo analisi dei full text. Sono stati analizzati in modo indipendente gli studi eleggibili per il rispetto dei criteri di inclusione e risolto eventuali disaccordi con il confronto e la discussione. Dopo la progettazione su foglio elettronico di un modello di codifica standardizzato e condiviso, da ogni studio sono stati estratti i seguenti dati: primo autore e anno, Paese, setting, partecipanti, criteri di inclusione ed esclusione, intervento, controllo, outcome e strumento di valutazione, numero di soggetti che hanno completato lo studio.
Qualità metodologica degli studi
È stata valutata in modo indipendente la qualità generale degli studi con la scala Jadad (Jadad et al., 1996).
Analisi e sintesi dei dati
L’analisi delle caratteristiche principali degli studi inclusi nella revisione e la sintesi dei risultati emersi sono state presentate in forma narrativa.
RISULTATI
Selezione degli studi
L’interrogazione, effettuata il 26 novembre 2021, ha restituito complessivamente 1021 record. Il processo di selezione è illustrato in Figura 1 secondo il flow diagram PRISMA (Page et al., 2021). Al netto dei record duplicati e di quelli non pertinenti dopo analisi di titolo e/o abstract, quattro studi sono stati esaminati per eleggibilità; uno è stato escluso in quanto non è un RCT (Choi et al., 2021), un altro perché l’intervento si basa essenzialmente sull’utilizzo di messaggistica di testo (Modi et al., 2016). Non sono stati identificati altri studi attraverso la ricerca manuale sulle riviste e il controllo delle bibliografie. Complessivamente, due RCT hanno soddisfatto i criteri di inclusione (Mirpuri et al., 2021; Si et al., 2020). Una sintesi delle loro caratteristiche principali è illustrata in Tabella 3.
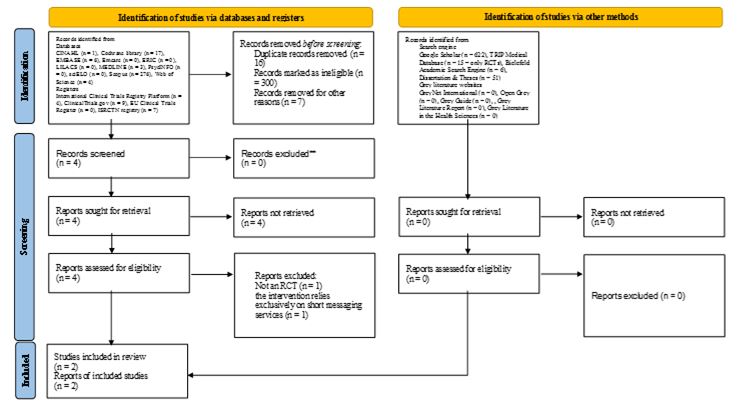
Figura 1. – Processo di screening dei record.
| Primo autore (anno) | Paese | Setting | Partecipanti | Criteri di inclusione | Criteri di esclusione | Intervento | Controllo | Outcome di interesse e strumento di valutazione | Soggetti che hanno completato lo studio |
| Mirpuri (2021) | India | Ambulatorio di neurologia di un ospedale di cure terziarie di New Delhi (India settentrionale) | N=96 soggetti randomizzati (48 per braccio) con diagnosi di epilessia e in trattamento da almeno un anno. Età media: 29 aa, genere femminile 59%, lavoratori 68%, diagnosi di epilessia generalizzata 32%, durata media di malattia: 13 aa, numero medio di farmaci antiepilettici prescritti: 3 | Adulti senza disabilità fisiche, in grado di tornare per i follow up, indipendenti nell’assunzione della terapia farmacologica, in possesso di uno smartphone | Non dichiarati | App per smartphone basata sull’aderenza alla terapia farmacologica e sulla capacità di autogestione della malattia preceduta da sessione formativa | Consultazione clinica di routine | Aderenza alla terapia farmacologica: 4-Point Morisky, Green and Levine Adherence Scale (MGLS) Capacità di autogestione: Epilepsy Self-Efficacy Scale Frequenza delle crisi: autoriferita
Valutazioni outcome eseguite al basale e al termine dell’intervento (12 settimane) |
N=84
(43/48 gruppo di intervento, 41/48 gruppo di controllo) |
| Si
(2020) |
Cina | Centro per l’epilessia di un ospedale di Chengdu (Cina occidentale) | N=380 soggetti (190 per braccio) con diagnosi di epilessia da più di un anno, con più di tre convulsioni nei 6 mesi precedenti.
Età media: 32 aa, genere femminile 46%, lavoratori 77%, diagnosi di epilessia generalizzata 17%, durata media di malattia: 13 aa, con un solo antiepilettico prescritto: 56% |
Età compresa tra 18 e 60 aa, residenza nei pressi dell’ospedale, in possesso e in grado di utilizzare uno smartphone | Grave disabilità neuropsichica o severa compromissione dello sviluppo neurocognitivo, malattie neurologiche, psicosi o altre gravi condizioni mediche, analfabetismo | App per smartphone preceduta da sessione formativa | Consultazione clinica di routine | Capacità di autogestione: Chinese Epilepsy Self- Management Scale (C- ESMS) Frequenza delle crisi: autoriferita
Valutazione capacità di autogestione eseguita al basale e a sei mesi dall’intervento
Valutazione frequenza delle crisi eseguita nei sei mesi precedenti e durante i sei mesi del follow up |
N=327
(176/190 gruppo di intervento, 151/190 gruppo di controllo) |
Tabella 3. – Caratteristiche principali degli RCT inclusi.
Caratteristiche principali degli studi
Gli RCT sono stati condotti in India (Mirpuri et al., 2021) e Cina (Si et al., 2020); ambedue hanno ricevuto il supporto di istituzioni governative. Il setting di studio è rappresentato da un ambulatorio di neurologia di un ospedale di cure terziarie (Mirpuri et al., 2021) e da un centro per l’epilessia di un ospedale metropolitano (Si et al., 2020). Sono stati randomizzati 476 partecipanti di età media compresa tra 29 e 32 anni (49% di genere femminile). La percentuale di soggetti lavoratori era compresa tra il 68% (Mirpuri et al., 2021) e il 77% (Si et al., 2020), quella di individui con crisi epilettiche generalizzate tra il 17% (Si et al., 2020) e il 32% (Mirpuri et al., 2021). La durata media di malattia dei partecipanti era di 13 anni in ambedue gli studi. Tutti i soggetti avevano accesso ad una connessione Internet ed erano in possesso e in grado di utilizzare uno smartphone. Gli RCT hanno implementato l’utilizzo di una app per smartphone per l’autogestione dell’epilessia in modalità multicomponente (es. sistema di promemoria dei farmaci, diario delle crisi, checklist sullo stile di vita, materiale didattico, portale medico, monitoraggio dei progressi, forum e blog educativi, teleconsulto). Ambedue gli studi hanno valutato la frequenza delle crisi convulsive autoriferita dai partecipanti; in uno (Mirpuri et al., 2021) la capacità di autogestione dell’epilessia è stata valutata con la Epilepsy Self-Efficacy Scale (ESES) (DiIorio et al., 2001), nell’altro (Si et al., 2020) con la versione cinese della Epilepsy Self- Management Scale (CESMS) (Xiao et al., 2018). ESES è una scala a 33 item che misura i diversi aspetti di autoefficacia nell’autogestione della malattia. Ogni item è valutato su una scala Likert a undici opzioni di risposta a cui corrispondono altrettanti score (da 0 a 10). I punteggi di ESES vanno da 0 a 330; a punteggio maggiore corrisponde maggiore autoefficacia. CESMS è una scala a 38 item che misura la frequenza d’uso delle pratiche di autogestione dell’epilessia. Ogni item è valutato su una scala Likert a cinque opzioni di risposta a cui corrispondono altrettanti score (da 1 a 5). I punteggi di ESMS vanno da 38 a 190; a punteggio maggiore corrisponde un uso più frequente di strategie di autogestione. L’aderenza al regime terapeutico è stata misurata da uno studio (Mirpuri et al., 2021) con la 4-Point Morisky, Green and Levine Adherence Scale (MGLS) (Morisky et al., 1986). MGLS è una scala a quattro item che valuta il verificarsi di uno specifico comportamento di non aderenza. Ad ogni item occorre rispondere con “sì” (1) o “no” (0). I punteggi di MGLS vanno da 0 a 4; a punteggio maggiore corrisponde un grado più elevato di non aderenza. I pazienti con un punteggio di 0 sono classificati come aderenti. Nello studio indiano (Mirpuri et al., 2021) la valutazione degli outcome è stata effettuata al basale e al termine dell’intervento (12 settimane), in quello cinese (Si et al., 2020) al basale e a sei mesi dall’intervento. Nell’RCT indiano (Mirpuri et al., 2021) il 10% dei soggetti randomizzati nel gruppo di intervento (5/48) e il 15% di quelli randomizzati nel gruppo di controllo (7/48) è stato perso al follow up. In quello cinese (Si et al., 2020) il 7% dei soggetti randomizzati nel gruppo di intervento (14/190) (non più contattabili: n = 3, non utilizzata l’app in modo discontinuo: n = 5, ritiratisi prima del completamento dello studio: n = 6) e il 21% di quelli randomizzati nel gruppo di controllo (39/190) (non più contattabili: n = 24, ritiratisi prima del completamento dello studio: n = 15) non è giunto alla valutazione al follow up.
Qualità metodologica degli studi inclusi
La valutazione della qualità metodologica degli studi è illustrata in Tabella 4. I due studi sono descritti come randomizzati ma in uno (Mirpuri et al., 2021) non è esplicitato il processo di randomizzazione. Un RCT è dichiarato come in doppio cieco (Si et al., 2020) ma la cecità non è descritta nè appropriata. Nel complesso, uno studio (Si et al., 2020) è di alta qualità (Jadad score = 3), l’altro (Mirpuri et al., 2021) di bassa qualità (Jadad score = 2)
| Scala Jadad | Mirpuri 2021 | Si 2020 |
| Lo studio è descritto come randomizzato? | 1 | 1 |
| Lo studio era descritto come in doppio cieco? | 0 | 1 |
| Era presente la descrizione dei persi al follow up? | 1 | 1 |
| La randomizzazione era descritta e appropriata? | 0 | 1 |
| La cecità era descritta e appropriata? | Non applicabile | -1 |
| Score | 2 | 3 |
| Qualità | bassa | alta |
Tabella 4. – Jadad score.
Risultati principali degli studi inclusi
L’approccio per la valutazione della frequenza delle crisi convulsive autoriferita dai partecipanti è stato diverso nei due RCT: uno ha valutato la percentuale di partecipanti che al termine dell’intervento hanno riferito la riduzione della frequenza delle crisi (Mirpuri et al., 2021), l’altro la percentuale di partecipanti che hanno riportato al follow up una diminuzione della frequenza percentuale delle crisi rispetto al basale (es. una riduzione della frequenza del 100% ha implicato l’assenza di crisi dal termine dell’intervento al follow up) (Si et al., 2020). La stessa diversità di approccio metodologico si è riscontrata nella misurazione dell’autogestione dell’epilessia. Un RCT (Mirpuri et al., 2021) ha valutato l’autoefficacia nella gestione della malattia, che è una delle componenti dell’autogestione, l’altro (Si et al., 2020) la capacità di autogestione complessiva dell’epilessia. L’aderenza terapeutica è stata misurata da un RCT (Mirpuri et al., 2021). Nessuno studio ha valutato la qualità di vita percepita.
Outcome primari
Frequenza delle crisi convulsive
In uno studio (Mirpuri et al., 2021) la percentuale di partecipanti con frequenza delle crisi ridotta al termine dell’intervento è stato maggiore nel braccio di controllo rispetto a quello d’intervento (9.8% vs 7%); nel braccio di controllo, rispetto al braccio di intervento si è più che dimezzata la percentuale di partecipanti con frequenza delle crisi aumentata (7.3% vs 16.3%). Le differenze registrate tra i due gruppi non hanno raggiunto la significatività statistica (p = 0.425). Nell’altro studio (Si et al., 2020) la percentuale di partecipanti del braccio di intervento che hanno dichiarato di essere stati liberi (riduzione del 100%) o quasi (riduzione del 75-100%) da crisi convulsive nei sei mesi successivi all’intervento è stata rispettivamente più che doppia (28% vs 12%) e tripla (12% vs 4%) di quanto riportato dai soggetti del braccio di controllo. Le differenze registrate tra i due gruppi sono state statisticamente molto significative (p < 0.001).
Autogestione della malattia
L’RCT che ha valutato la capacità di autoefficacia nella gestione dell’epilessia (Mirpuri et al., 2021) ha registrato un miglioramento a fine intervento nel braccio di intervento rispetto al basale (ESES score 269.5 vs 279.5) a fronte di un peggioramento evidenziato in quello di controllo (ESES score 289.75 vs 274.4). Le differenze rilevate sono state statisticamente significative (p = 0.013). Gli autori dell’RCT che ha misurato la capacità di autogestione della malattia (Si et al., 2020) hanno rilevato a sei mesi dall’intervento un miglioramento statisticamente molto significativo (p < 0.001) nel braccio di intervento rispetto a quello di controllo (C-ESMS score 144.4 vs 125.4). Tuttavia non sono noti i valori al basale dei rispettivi gruppi.
Outcome secondari
Aderenza al regime terapeutico
L’unico studio che ha misurato l’aderenza al regime terapeutico (Mirpuri et al., 2021) ha evidenziato un aumento statisticamente molto significativo (p = 0.002) nella percentuale di aderenti tra i partecipanti del braccio sperimentale a fine intervento rispetto al basale (68.8% vs 16.7%) rispetto a quanto avvenuto per il braccio di controllo (39.6% vs 29.2%).
Altri outcome
Lo studio indiano (Mirpuri et al., 2021) ha chiesto ai partecipanti del gruppo di intervento che hanno completato la sperimentazione (n = 43) di esprimere un parere sull’app; il 79% l’ha ritenuta utile, il 72% (31/43) ha affermato di averla utilizzata per tutta la durata dello studio. Il 28% (12/43) ha smesso di utilizzarla perché affaticava gli occhi (n = 2), a causa di un ricovero dovuto a complicazioni (n = 1), perché troppo difficile da usare (n = 2) o ritenuta non utile (n = 7). Tra i partecipanti al gruppo di intervento che hanno utilizzato l’app per tutta la durata dello studio (n = 31), più di tre su quattro hanno apprezzato la parte interattiva del sistema di promemoria. Nello studio cinese (Si et al., 2020) la soddisfazione per l’app non è stata valutata formalmente.
DISCUSSIONE
Sintesi dei principali risultati
La presente revisione sistematica si è proposta di valutare l’efficacia delle app per smartphone per l’autogestione dell’epilessia. Rispetto alle cure standard, l’intervento sembra promettente per migliorare la capacità di autogestione della malattia e ha le potenzialità per aumentare la percentuale di soggetti aderenti al regime terapeutico. L’effetto sulla frequenza delle crisi convulsive è ancora sub iudice, in quanto i risultati sono misti. Allo stato attuale non si conoscono gli effetti dell’intervento sulla qualità di vita percepita. I risultati illustrati vanno considerati con molta cautela alla luce del numero ridotto di RCT inclusi e di soggetti randomizzati (n = 476), ulteriormente ridottosi del 31% (149/476) a fine intervento (Mirpuri et al., 2021) o al follow up (Si et al., 2020).
Implicazioni per la pratica
Le prove disponibili in letteratura supportano la fattibilità, l’accettabilità e l’efficacia degli interventi di salute digitale in diverse condizioni cliniche croniche, inclusa l’epilessia (Asadi‐Pooya et al., 2021). Le app per smartphone possono offrire un comodo accesso a contenuti educativi rilevanti e funzioni aggiuntive che vanno dai diari elettronici integrati ai promemoria sui farmaci alla registrazione delle crisi (Pandher et al., 2016). I vantaggi unici di questa tecnologia consistono ad esempio in una migliore accessibilità, archiviazione e condivisione da remoto dei dati e nella possibilità di generare grafici automatizzati per ottimizzare il controllo delle crisi (Pandher et al., 2016). In accordo con quanto evidenziato dall’analisi degli RCT, il diario delle crisi è lo strumento più presente nelle app ed è tradizionalmente raccomandato per valutare l’efficacia della terapia farmacologica e riconoscere situazioni pericolose o di emergenza come la morte improvvisa (Sudden Unexpected Death in Epilepsy – SUDEP) (Alzamanan et al., 2021; Escoffery et al., 2018; Mohammadzadeh et al., 2021; Pandher et al., 2016; Shegog et al., 2020; von Spiczak et al., 2021). Inoltre le app possono essere di supporto ai pazienti nella gestione dei farmaci (Aliasgharpour et al., 2013; Alzamanan et al., 2021; Escoffery et al., 2018; Mohammadzadeh et al., 2021). La non aderenza alla terapia è un problema critico per le persone con epilessia (Lin et al., 2016): si stima che il 30-60% di costoro manifesti un’aderenza subottimale (Mohammadzadeh et al., 2021).
Questo può portare ad un aumento della frequenza delle crisi (Lua et al., 2012), delle consultazioni e delle ospedalizzazioni evitabili nonché dei costi dell’assistenza sanitaria (Demonceau et al., 2013). Una componente importante che incide sull’aderenza è lo stigma e la discriminazione che circondano l’epilessia, spesso più difficili da superare delle stesse crisi convulsive e che possono scoraggiare le persone dal cercare un trattamento, per evitare di essere identificate con la malattia (WHO, 2019). A conferma di ciò, in alcuni paesi la legislazione riflette secoli di incomprensioni sull’epilessia; in Cina e in India, ad esempio, la malattia è considerata una ragione sufficiente per proibire o annullare i matrimoni (WHO. 2019). Proprio come avviene per i farmaci, anche risorse digitali come le app per smartphone devono affrontare problemi di non aderenza (Shegog et al., 2020): si stima che il 46% delle persone che ha scaricato un’app per la salute non la utilizzi più (Krebs et al., 2015). Nell’RCT indiano (Mirpuri et al., 2021) ad esempio, il 75% (n =9/12) dei soggetti del gruppo di intervento ha smesso di utilizzare l’app perché la riteneva inutile (n = 7) o troppo difficile da usare (n = 2). Da parte loro, le app dovrebbero aderire a principi di progettazione che pongano attenzione a parametri di fruibilità e rispettino indicatori di qualità come la facilità d’uso, la comprensibilità, la credibilità, l’affidabilità, la completezza, l’accuratezza, l’aggiornamento continuo delle informazioni e l’appeal motivazionale (Mohammadzadeh et al., 2021; Pandher et al., 2016; Perzynski et al., 2017; Shegog et al., 2020). In fase di sviluppo andrebbero coinvolti tutti i portatori di interesse, come i medici e in primis gli epilettologi, i farmacisti, gli infermieri, i pazienti e i caregiver (Alzamanan et al., 2021; Escoffery et al., 2018). Attualmente si assiste ad una carenza di regolamentazione sulla protezione e il trattamento dei dati sensibili, a problemi di conformità alle linee guida di pratica clinica e alla mancanza di consenso sul livello di prove e sulla dimensione d’effetto ritenuta rilevante a supporto dell’utilizzo di app per la salute (Chaet et al., 2017; Leenen et al., 2014; Mohammadzadeh et al., 2021; Pandher et al., 2016; Santos-Peyret et al., 2020; Shegog et al., 2020).
Queste barriere limitano significativamente la promozione, l’adozione e la diffusione in ambito sanitario di tali risorse digitali. Molte app non sono sottoposte a valutazione di qualità (Shegog et al., 2020): l’uso di strumenti come la Mobile App Rating Scale (MARS) (Stoyanov et al., 2015) potrebbe rivelarsi molto utile (Mohammadzadeh et al., 2021) nell’ottica di contribuire a certificare un’app come prodotto medico, requisito necessario per il riconoscimento formale di applicazione sanitaria digitale. Ciò potrebbe rappresentare uno sviluppo positivo per disporre in futuro di app certificate nel campo dell’epilettologia (von Spiczak et al., 2021).
Implicazioni per la ricerca
Sono necessari RCT di maggiore dimensione campionaria e qualità metodologica migliore per aumentare la base di prove d’efficacia a favore dell’utilizzo di app per smartphone per l’autogestione dell’epilessia. Tuttavia, per la natura dell’intervento, non è facile garantire che i partecipanti e gli operatori sanitari siano in cieco. Avendo a disposizione più studi con ampi campioni, sarebbe possibile effettuare analisi per sottogruppi al fine di valutare l’efficacia dell’intervento in funzione ad esempio del genere, dell’età di prima diagnosi di malattia, del numero medio di farmaci antiepilettici assunti giornalmente, dello status socioeconomico, della cultura di provenienza. Occorre compiere ricerche per verificare il rapporto costi-benefici allo scopo di supportare la motivazione all’adozione di app nella pratica clinica (Santos-Peyret et al., 2020; Shegog et al., 2020). Studi ulteriori andrebbero promossi per valutare l’effetto dell’intervento sulla qualità della vita, outcome non ancora ben studiato (von Spiczak et al., 2021) e non affrontato negli RCT analizzati.
Forza e limiti dello studio
Allo stato attuale sono stati effettuati due soli RCT inerenti l’argomento, con dimensione campionaria ridotta, di qualità metodologica migliorabile, piuttosto eterogenei tra di loro in termini di conduzione dello studio e valutazione degli outcome nonchè di provenienza geografica ed estrazione culturale molto differente. Complessivamente questi limiti impongono molta cautela nel valutare l’impatto dei risultati ottenuti sulle persone con epilessia. Pur tuttavia, a nostra conoscenza questa è la prima revisione sistematica finalizzata a valutare l’efficacia delle app per smartphone per l’autogestione dell’epilessia.
CONCLUSIONI
La revisione sistematica ha messo in rilievo risultati promettenti sull’efficacia delle app per smartphone per l’autogestione dell’epilessia, ma occorrono altre conferme al trend positivo osservato tramite ulteriori ricerche. Non è attualmente possibile dare un giudizio sull’effetto dell’intervento sul controllo delle crisi convulsive.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.






