INTRODUZIONE
La maggior parte degli eventi avversi prevenibili si annida nel processo terapeutico, che deve essere quindi presidiato come possibile fonte di rischio in tutte le sue fasi, dalla prescrizione alla somministrazione (Ministero della Salute, 2008).
Nell’articolato processo che va dalla prescrizione alla somministrazione di un farmaco, i momenti di errore potenziale sono molteplici e la fase labelling, ovvero di etichettatura, è da molto tempo considerata una tappa importante nella gestione della sicurezza (Centro Gestione Rischio Clinico – Regione Toscana, 2018) soprattutto riguardo ai farmaci somministrati per via endovenosa mediante infusione lenta.
Molta attenzione è stata posta sulla fase di preparazione del farmaco e sono state introdotte nel tempo alcune pratiche di sicurezza volte a ridurre i possibili rischi connessi (es. colore diversificato delle etichette) (SIAARTI, 2019).
IL NOSTRO PERCORSO
Presso la Fondazione Toscana Gabriele Monasterio (FTGM) è in uso da tempo la eSTU, che risponde ai requisiti di qualità e sicurezza della Buona Pratica Clinica (Centro Gestione Rischio Clinico – Regione Toscana, 2010).
Da settembre 2019 è stato costituito un gruppo multidisciplinare che ha lavorato per ottenere un modulo della eSTU dedicato alla Sala Operatoria, per consentire di tracciare correttamente la prescrizione e la somministrazione dei farmaci utilizzati durante l’intervento cardiochirurgico.
L’etichettatura delle siringhe utilizzate sulle pompe-siringa per l’infusione continua dei farmaci è passata attraverso tre diverse tappe in evoluzione.
Inizialmente l’etichetta del farmaco veniva preparata dall’infermiere responsabile della somministrazione, attraverso l’utilizzo di un cerotto da applicare alla siringa, su cui veniva scritto a penna o con un pennarello il nome del farmaco, il dosaggio e la data di ricostituzione.
Successivamente si è passati a utilizzare delle etichette prestampate su fogli A4 in cui era presente il nome del farmaco e spazi vuoti in cui poter scrivere a penna il dosaggio, data di ricostituzione e firma dell’infermiere (Fig. 1).
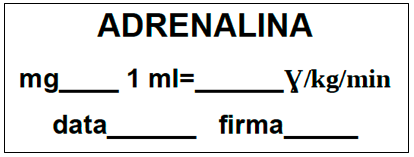
Figura 1. – Etichetta farmaco compilabile.
Infine si è giunti all’utilizzo della eSTU, in quanto è emersa la necessità di poter arrivare a generare delle etichette partendo direttamente dai dati anagrafici del paziente e di prescrizione presenti nella cartella informatizzata, senza alcuna trascrizione manuale. Questa nuova funzionalità si pone l’obiettivo di garantire il rispetto delle Buone Pratiche per la sicurezza e della Raccomandazione Ministeriale n.7/2008 sull’etichettatura delle formulazioni endovenose ricostituite, fase nella quale si sottolinea l’importanza di etichette quanto più esaustive possibili in termini di tracciabilità.
Per la realizzazione dell’etichetta definitiva si è utilizzato materiale già presente: infatti il format delle etichette 25 x 55 mm corrisponde alla dimensione standard delle stampanti per etichette che si trovano nelle unità operative e che vengono utilizzate quotidianamente per l’etichettatura dei campioni da inviare nei laboratori analisi, centri trasfusionali o laboratori microbiologici.
L’etichetta ha subito una progressiva evoluzione: la prima versione (febbraio 2021) ricordava le etichette scritte a penna utilizzate fino a quel momento, contenendo scarse informazioni riguardanti solamente nome del farmaco, dosaggio, data di preparazione e nome dell’infermiere preparatore (Fig. 2).

Figura 2. – Etichetta farmaco versione 1.
Il coinvolgimento del gruppo di lavoro multidisciplinare della Fondazione Toscana Gabriele Monasterio, composto da infermieri di anestesia e analisti programmatori, medici anestesisti, farmacisti e Clinical Risk Manager, ha portato alla realizzazione di nuove etichette contenenti informazioni sempre più dettagliate ed accurate, fino ad arrivare, dopo 4 versioni di prova, all’etichetta definitiva (settembre 2021).
L’etichettatura tramite eSTU delle formulazioni ricostituite rispetta ed implementa i termini di tracciabilità previsti dalle normative (SIAARTI, 2019).
Al suo interno infatti troviamo (Fig. 3):
– Riconoscimento univoco del paziente a cui il farmaco è stato destinato tramite cognome, nome e data di nascita
– Principio attivo del farmaco
– Codice Ministeriale del Farmaco o più semplicemente “codice Minsan”, ovvero il numero che il Ministero della Salute assegna ad ogni articolo, farmaco, dispositivo medico, presidio medico-chirurgico, parafarmaco, nel momento in cui viene registrato prima di essere immesso in commercio. È composto da 9 caratteri numerici e per i farmaci coincide con l’Autorizzazione all’Immissione in Commercio (A.I.C.), che viene rilasciata dall’AIFA del Ministero della Salute italiano
– Dose di farmaco prescritta dal medico ed allestita dall’infermiere, ed eventuale diluizione (nome del diluente e volume totale della soluzione allestita)
– Concentrazione del farmaco per ml calcolato in base al peso del paziente
– Data ed ora della preparazione
– Spazio per la firma del responsabile della preparazione e della somministrazione.

Figura 3. – Etichetta farmaco.
Infine è stata creata un’ulteriore etichetta (Fig. 4), detta “bandierina”, da posizionare sul deflussore della siringa, in prossimità dell’accesso vascolare in cui si intende infondere il farmaco, contenente: nome commerciale del farmaco, data ed ora della ricostituzione dello stesso. Queste informazioni sono necessarie sia per poter identificare immediatamente la linea infusionale in caso di infusioni multiple, sia, ed in maggior misura, per poter stabilire con precisione il momento della preparazione del farmaco. Questo può permettere all’infermiere di adempiere alla sostituzione della linea infusionale nelle tempistiche corrette, come stabilito dalle linee guida internazionali (Centers for Disease Control and Prevention, 2011).
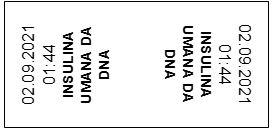
Figura 4. – Etichetta deflussore – “bandierina”.
L’introduzione di questa nuova tecnologia è stata condivisa con tutti gli operatori, medici anestesisti ed infermieri di anestesia utilizzatori della eSTU. Dall’inizio del suo utilizzo (Febbraio 2021) ci eravamo dati un tempo di prova di circa 6 mesi, per poter dare modo a tutti i professionisti di poter conoscere appieno le nuove modalità operative e prendere confidenza con il nuovo processo di etichettatura. Questa tempistica è stata invece dimezzata per la facilità e semplicità del sistema, che permette in pochi semplici clic di arrivare al risultato finale.
CONCLUSIONI
Il nuovo processo di etichettatura tramite eSTU non solo consente una rapida e sicura identificazione del farmaco ricostituito, ma al tempo stesso risulta chiaro e completo, rispondendo così alle specifiche esigenze di sicurezza e tracciabilità richieste dalla normativa vigente.
Proprio per questo motivo, il nostro lavoro è stato presentato ad una riunione dei coordinatori infermieristici della nostra Azienda ed è stato accolto come un importante strumento per poter diminuire in maniera significativa i rischi correlati alla somministrazione dei farmaci. Il 100% delle unità operative che utilizzano la eSTU ha espresso la volontà di voler usufruire di questo nuovo sistema di etichettatura (Fig. 5).

Figura 5. – Siringa con etichette.
Come noto in letteratura, l’introduzione di una nuova tecnologia deve essere condivisa con tutti i soggetti coinvolti: risulta quindi di primaria importanza il fattore umano (Yazici, 2014).
È inoltre ampiamente dimostrato (Carr et al, 2010; Ting et al, 2011) come uno staff competente, che sia stato adeguatamente formato, potrà fornire un servizio qualitativamente superiore e sarà più predisposto ad apprendere e operare con nuove tecnologie (De Menezes, 2012; Sykes et al, 2009). Questa potrebbe essere la chiave per introdurre efficacemente dei sistemi innovativi all’interno delle strutture ospedaliere.
La dimostrazione dei benefici significativi derivanti dagli interventi legati alla sicurezza delle cure è notoriamente difficile (Fasting et al, 2000; Orser, 2000).
Anche se nel database del Rischio Clinico della nostra Azienda non esistono segnalazioni su Near-Miss (Ministero della Salute, 2011) o aventi avversi legati all’etichettatura dei farmaci, ci auguriamo che il nostro lavoro, grazie alla collaborazione multi-disciplinare tra i professionisti interessati nel processo di prescrizione-allestimento-somministrazione, possa contribuire a ridurre i possibili rischi di errore in terapia e dei conseguenti eventi avversi prevenibili, e possa essere preso come esempio da altre realtà ospedaliere.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.