INTRODUZIONE
Per ictus si intende un gruppo di condizioni patologiche caratterizzate da perdita improvvisa e non convulsiva della funzione neurologica, a causa di ischemia cerebrale o emorragie intracraniche (Adams, 1997). L’ictus è una delle principali cause di disabilità a livello globale (Dobkin, 2005). Sebbene nei Paesi ad alto reddito si assista alla diminuzione della sua incidenza (Feigin et al., 2009) e i progressi nella gestione dell’ictus acuto abbiano portato a una diminuzione della mortalità correlata, il numero complessivo di persone con ictus è in aumento a causa dell’invecchiamento della popolazione generale.
Una delle complicanze secondarie più comuni dopo l’ictus è rappresentata dalle cadute (Moroz et al., 2004). I sopravvissuti all’ictus cadono quasi il doppio dei coetanei sani; le cadute possono costituire fino al 40% di tutti gli eventi avversi di cui sono vittime in ospedale (Holloway et al., 2007). Da un minimo del 5% ad un massimo del 65% delle persone con ictus cade almeno una volta durante la degenza (Chaiwanichsiri et al., 2006; Schmid et al., 2010; Suzuki et al., 2005; Teasell et al., 2002); le cadute ricorrenti sono stimate al 2,6% (Tutuarima et al., 1997). L’incidenza delle cadute nella prima settimana dall’ictus è del 7% (Indredavik et al., 2008), mentre dopo 1-6 mesi cade il 25-73% delle persone (Kerse et al., 2008; Indredavik et al., 2008; Mackintosh et al., 2006) e si stima che quasi la metà lo faccia nei primi 2 mesi dalla dimissione, con un’altra metà che riporta cadute ricorrenti (Mackintosh et al., 2005; Tilson et al., 2012). Dopo 6-12 mesi dall’ictus l’incidenza è del 40-50% (Belgen et al., 2006; Harris et al., 2005); nel primo anno l’incidenza è stimata al 36-75% (Sackley et al., 2008; Schmid et al., 2010; Simpson et al., 2011; Weerdesteyn et al., 2008).
Nei servizi di riabilitazione post ictus l’obiettivo primario è quello di migliorare la qualità dell’andatura e ripristinare un buon controllo dell’equilibrio (Leddy et al., 2016; Stretton CM et al., 2016); in questo contesto i pazienti sono incoraggiati a muoversi e svolgere attività in modo indipendente, ma questo aumenta il rischio di cadute nonostante l’attuazione di un programma aggressivo di prevenzione: l’incidenza di quelle correlate all’ictus è infatti pari al 14-48% (Rabadi et al., 2008; Suzuki et al., 2005).
Quasi un soggetto su tre subisce un danno correlato alla caduta (Teasell et al., 2002); nel 5% dei casi si tratta di lesioni gravi o fratture (Dennis et al., 2002; Langhorne et al., 2000). Queste ultime possono essere fino a quattro volte più frequenti rispetto alla popolazione generale (Pouwels et al., 2009), anche per il contributo dato dalla riduzione della densità minerale ossea associata all’ictus (Eng, Das, 2012); la maggior parte di esse (27%) coinvolge l’anca o il bacino (Truelsen et al., 2006).
Le conseguenze della caduta hanno un impatto non solo dal punto di vista fisico, ma anche sul versante psicologico (Holloway et al., 2007). Infatti si registrano livelli più elevati di ansia e umore depresso (Hyndman et al., 2002; Jorgensen et al., 2002), una maggiore paura di ulteriori cadute e una diminuita convinzione che si possa deambulare autonomamente senza cadere, il che potenzialmente porta a limitare le attività di vita quotidiana, aggravando ulteriormente i deficit di funzionalità fisica e aumentando lo stress del caregiver (Andersson et al., 2008; Suzuki et al., 2005).
I pazienti con ictus che rientrano in ospedale per lesioni o fratture correlate a cadute riportano una maggiore durata dei tempi di degenza, più probabilità di subire un declino funzionale e un rischio aggiuntivo di cadere al ritorno a casa (Holloway et al., 2007; Mackintosh et al., 2006; Schmid et al., 2010).
I meccanismi invocati per giustificare le frequenti cadute riportate dai sopravvissuti all’ictus sono diversi: compromissione dell’equilibrio per scarsa coordinazione dei segmenti corporei (Hyndman et al., 2002; Patterson et al., 2008) o paralisi motoria di un lato del corpo (Kim, Eng, 2003); difficoltà a mantenere l’equilibrio quando sono necessari aggiustamenti locomotori adattivi, come evitare gli ostacoli (Harris et al., 2005; Simpson et al., 2011); debolezza muscolare, perdita sensoriale, anomalie della visione ed eminattenzione spaziale (Weerdesteyn et al., 2008). Inoltre l’alta prevalenza di disabilità comunicativa (O’Halloran et al., 2009), correlata a una serie di condizioni associate, tra cui afasia o disartria, rende problematico per le persone con ictus chiedere aiuto in caso di caduta imminente o soccorso se appena avvenuta, con rischio più elevato di incorrere in gravi conseguenze rispetto ai pari età sani.
Scopo di questa revisione è un bilancio dei fattori di rischio di cadute, per giungere a descrivere i relativi interventi di prevenzione nei soggetti con ictus. Nello specifico, i quesiti clinici a cui ci si propone di fornire risposta sono i seguenti: quali sono i fattori di rischio che favoriscono l’insorgenza di cadute nei soggetti con ictus? Quali sono gli interventi implementati per prevenire l’insorgenza di cadute nei soggetti con ictus e quale la loro efficacia?
METODI
Per rispondere ai quesiti è stata condotta una overview di revisioni della letteratura, al fine di proporre una sintesi esaustiva e aggiornata delle evidenze disponibili sull’argomento di interesse (Cooper et al., 2012; Hartling et al., 2014) a mezzo di un numero relativamente contenuto di documenti.
Il loro reperimento è avvenuto interrogando i database biomedici Cochrane Library, PubMed, CINAHL, EMBASE e Scopus, il motore di ricerca Web of Science e il registro di revisioni sistematiche PROSPERO (NIHR-CRD University of York, 2021). Gli autori hanno implementato in modo indipendente una strategia di ricerca per termini MeSH o parole chiave, in precedenza concordate, in funzione delle caratteristiche proprie della fonte consultata. I record ottenuti non sono stati sottoposti a limiti di data o lingua di pubblicazione. I criteri di inclusione sono stati i seguenti: 1) popolazione – soggetti adulti affetti da ictus, ischemico o emorragico, a prescindere dal grado di severità, dal tempo trascorso dall’evento acuto e dal setting (ospedale, centro di riabilitazione, cure a lungo termine, comunità); 2) esposizione/intervento – fattori di rischio e interventi di prevenzione delle cadute post ictus; 3) confronto – cure usuali o altro/i intervento/i; 4) outcome – numero di cadute; 5) disegno di studio – revisioni sistematiche (con/senza meta-analisi) o non sistematiche.
Una prima selezione dei record è avvenuta in modo indipendente tra i due autori dopo lettura di titolo e/o abstract; nei casi dubbi si è proceduto alla lettura del documento in full text e ad una successiva esclusione per non rispetto di almeno uno dei criteri di inclusione previsti. Gli studi inclusi sono stati analizzati ed è stata operata una sintesi narrativa e tramite la creazione di tabelle sinottiche dei principali risultati emersi dopo la creazione in Microsoft Excel 2016 di un formato di precodifica di dati e informazioni ad hoc. In caso di divergenze sorte nelle fasi di selezione, analisi o sintesi gli autori, dopo discussione, hanno raggiunto un accordo comune.
RISULTATI
L’interrogazione delle fonti di potenziale reperimento dei documenti è stata effettuata il 16 dicembre 2020. I record individuati sono stati complessivamente 221 (Tab. 1).
| Fonte | Stringa di ricerca | Limiti | Record |
| Cochrane Library | MeSH descriptor: [Accidental Falls] explode all trees
AND MeSH descriptor: [Stroke] explode all trees |
Revisioni Cochrane | 1 |
| PubMed | (“Accidental Falls”[Mesh])
AND (“Stroke”[Mesh]) |
Revisioni | 45 |
| CINAHL | (MH “Accidental Falls”)
AND (MH “Stroke”) |
Revisioni
Escludi citazioni di PubMed |
16 |
| EMBASE | ‘falling’/exp
AND ‘cerebrovascular accident’/exp AND ‘review’/exp |
Escludi citazioni di PubMed | 90 |
| Web of Science | TITLE: (falls)
AND TITLE: (stroke) AND TOPIC: (review) |
– | 28 |
| Scopus | TITLE (falls)
AND TITLE (stroke) AND TITLE-ABS-KEY (review) |
– | 35 |
| PROSPERO | MeSH DESCRIPTOR Accidental Falls EXPLODE ALL TREES
AND MeSH DESCRIPTOR Stroke EXPLODE ALL TREES |
– | 6 |
Tabella 1. – Strategia di ricerca.
Al termine del processo di rimozione dei duplicati, selezione per titolo e/o abstract e, nei casi dubbi, esclusione dopo lettura del full text, sono stati inclusi nella overview dieci documenti (Batchelor et al., 2010; Batchelor et al., 2012; Campbell, Matthews, 2010; Denissen et al., 2019; Rensink et al., 2009; Sullivan et al., 2020; Verheyden et al., 2013; Walsh et al., 2016; Walsh et al., 2017; Winser et al., 2018) (Fig. 1).
Essi sono stati pubblicati tra il 2009 (Rensink et al., 2009) e il 2020 (Sullivan et al., 2020); 5 sono australiani (Batchelor et al., 2010; Batchelor et al., 2012; Denissen et al., 2019; Sullivan et al., 2020; Verheyden et al., 2013); 3 europei – frutto di una collaborazione di ricercatori provenienti da Belgio, Gran Bretagna e Paesi Bassi (Rensink et al., 2009; Walsh et al., 2016; Walsh et al., 2017); 1 è statunitense (Campbell, Matthews, 2010); 1 è cinese (Winser et al., 2018).
In termini di disegno di studio, 1 è una rassegna (Batchelor et al., 2012), 1 una revisione integrativa (Campbell, Matthews, 2010), 3 sono revisioni sistematiche (Rensink et al., 2009; Walsh et al., 2016; Walsh et al., 2017) e 5 sono revisioni sistematiche con meta-analisi (Batchelor et al., 2010; Denissen et al., 2019; Sullivan et al., 2020; Verheyden et al., 2013; Winser et al., 2018).
Uno studio (Winser et al., 2018) ha come popolazione target i soggetti colpiti da una varietà di condizioni neurologiche tra cui l’ictus, mentre gli altri (Batchelor et al., 2010; Batchelor et al., 2012; Campbell, Matthews, 2010; Denissen et al., 2019; Rensink et al., 2009; Sullivan et al., 2020; Verheyden et al., 2013; Walsh et al., 2016; Walsh et al., 2017) focalizzano la loro attenzione esclusivamente su individui affetti da ictus.
In termini di obiettivo, 3 studi (Campbell, Matthews, 2010; Rensink et al., 2009; Sullivan et al., 2020) si propongono di identificare le caratteristiche e il ruolo dei fattori di rischio di caduta post ictus e 1 (Walsh et al., 2016) di identificare, valutare criticamente e riassumere i modelli di previsione del rischio; 3 studi (Batchelor et al., 2010; Denissen et al., 2019; Verheyden et al., 2013) valutano l’efficacia di tutti gli interventi volti a prevenire le cadute e 1 (Winser et al., 2018) l’effetto specifico del Tai Chi Chuan. Inoltre 1 studio (Batchelor et al., 2012) si occupa sia di evidenziare i fattori di rischio che di riassumere le prove sulla prevenzione delle cadute, mentre 1 studio (Walsh et al., 2017) si prefigge di esplorare la percezione del rischio di cadute all’interno dell’esperienza di recupero dell’ictus dal punto di vista delle persone che sono afflitte dalla condizione patologica. Le caratteristiche principali delle revisioni incluse sono disponibili su richiesta tramite il contatto mail dell’autore corrispondente.
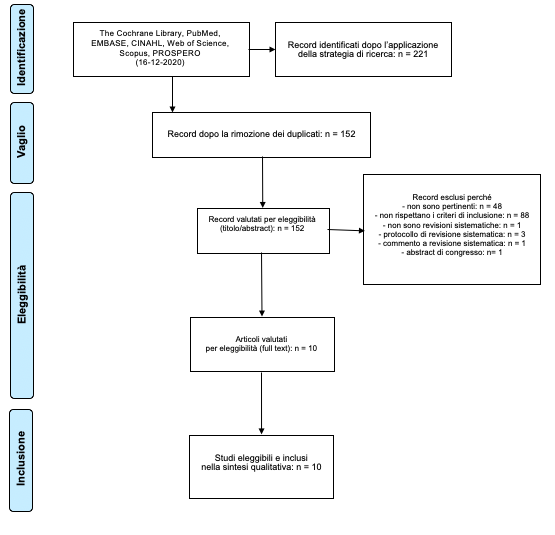
Figura 1. – Processo di selezione dei record.
Fattori di rischio per cadute post ictus
In Tab. 2 sono descritti i fattori di rischio di cadute accidentali nei soggetti con ictus ordinati in funzione del livello di supporto empirico.
I fattori di rischio con più forte supporto empirico sono: la compromissione dell’equilibrio (Campbell, Matthews, 2010; Walsh et al., 2016); 2); l’eminattenzione visuospaziale, ovvero un disturbo della cognizione spaziale in cui, spesso a seguito di una lesione cerebrale dell’emisfero destro, il paziente ha difficoltà ad esplorare lo spazio controlaterale alla lesione e non è consapevole degli stimoli presenti in quella porzione di spazio esterno o corporeo e dei relativi disordini funzionali (Campbell, Matthews, 2010; Walsh et al., 2016); la presenza di deficit di autocura, misurato tramite strumenti quali la Functional Indipendence Measure – FIM, il Barthel Index o il Katz Index (Campbell, Matthews, 2010; Rensink et al., 2009).
Per valutare il rischio di cadute in letteratura è citato l’utilizzo di due strumenti applicati specificamente sugli individui con ictus: il Downton Index e la STRATIFY Scale, che tuttavia su questa popolazione registrano bassi valori rispettivamente di specificità e sensibilità (Rensink et al., 2009). Sono utilizzati anche strumenti non sviluppati appositamente per valutare il rischio di cadute: il Test Timed-Up-and-Go (TUG), che però non è in grado di rilevare differenze significative tra individui caduti e non caduti e quindi manca di potere discernente; il Test Stop Walking When Talking (SWWT) che è di sensibilità modesta; la Berg Balance Scale (BBS), con specificità insoddisfacente (Rensink et al., 2009).
| Supporto empirico forte | Supporto empirico equivoco | Supporto empirico debole o assente |
| – compromissione dell’equilibrio (Batchelor F et al., 2012; Campbell GB, Matthews JT, 2010; Walsh M et al., 2016) – eminattenzione visuospaziale (Batchelor F et al., 2012; Campbell GB, Matthews JT, 2010; Walsh M et al., 2016) (disturbo della cognizione spaziale nel quale, a seguito spesso di una lesione cerebrale nell’emisfero destro, il paziente ha difficoltà ad esplorare lo spazio controlaterale alla lesione e non è consapevole degli stimoli presenti in quella porzione di spazio esterno o corporeo e dei relativi disordini funzionali) – deficit di autocura (es. bassi punteggi FIM, Barthel Index, Katz Index) (Batchelor F et al., 2012; Campbell GB, Matthews JT, 2010; Rensink M et al., 2009) |
– deterioramento cognitivo (Campbell GB, Matthews JT, 2010; Rensink M et al., 2009) – grado di compromissione motoria nell’emiparesi (Campbell GB, Matthews JT, 2010; Rensink M et al., 2009) |
– utilizzo di FRID (Fall Risk Increasing Drugs) (Campbell GB, Matthews JT, 2010)
– utilizzo di lenti bifocali (Rensink M et al., 2009) – disturbi motori del linguaggio (es. disartria) (Campbell GB, Matthews JT, 2010; Rensink M et al., 2009; Sullivan R et al., 2020) – degenza prolungata (Batchelor F et al., 2012) – contingente assistenziale ridotto (Batchelor F et al., 2012) |
Tabella 2. – Fattori di rischio per cadute post ictus.
La stragrande maggioranza (80%) delle cadute si verifica durante il giorno (Rensink et al., 2009), con frequenze di picco comprese tra le 10 e le 11 del mattino e le 5 e le 6 del pomeriggio (Batchelor et al., 2012).
I primi giorni dopo l’ictus sono quelli più a rischio: in questo periodo avviene circa la metà delle cadute (Rensink et al., 2009). Gli eventi si verificano comunemente al letto del paziente, durante il trasferimento dal letto alla sedia a rotelle o viceversa, specie in assenza di supervisione, e in bagno/toilette (Batchelor et al., 2012; Rensink et al., 2009). A domicilio le persone cadono più spesso in soggiorno, in camera da letto o in giardino, mentre stanno svolgendo attività di deambulazione complesse, come salire gradini, evitare ostacoli o compiere delle svolte (Batchelor et al., 2012).
Sebbene le cadute post ictus siano un’esperienza comune, possono favorire la paura di cadere che si sviluppa su un continuum ai cui estremi si trovano un “sano senso di paura” e “paura pervasiva di cadere” (Walsh et al., 2017). Quest’ultima rappresenta una barriera alla partecipazione alla vita di comunità, che va ad aggiungersi alle altre, di tipo psicologico, ambientale, fisico o sociale associate alla caduta e che potrebbero favorire la tendenza all’isolamento dei sopravvissuti all’ictus (Walsh et al., 2017).
Il progressivo ritiro dalla partecipazione alla vita di comunità da parte di alcuni individui deriva dalla necessità di proteggersi da: rischi dovuti a barriere ambientali come le superfici irregolari e gli ostacoli; scarsa consapevolezza degli altri della loro condizione, avendo sperimentato di essere stati spinti o urtati mentre si trovavano in luoghi pubblici; percezione di essere oggetto di stigma per l’utilizzo di un ausilio per la deambulazione, di per sé simbolo di disabilità; imbarazzo derivante da una eventuale caduta in pubblico (Walsh et al., 2017). Per superare la paura di cadere e le barriere alla partecipazione alla vita sociale e affrontare le sfide di una maggiore dipendenza funzionale, è importante che nella persona con ictus emerga un progressivo adattamento emotivo e cognitivo, anche attraverso l’incoraggiamento e il sostegno dei congiunti (Walsh et al., 2017).
Interventi preventivi per cadute post ictus
Terapia fisica
Sia complessivamente (Batchelor et al., 2010; Batchelor et al., 2012; Verheyden et al., 2013) che nella fase cronica post ictus (Denissen et al., 2019), sembra non esserci alcun beneficio dell’esercizio fisico sul numero di cadute; tuttavia, limitando l’analisi alla fase acuta, si registra una riduzione statisticamente significativa (p<0,05) del numero di cadute (Denissen et al., 2019). L’implementazione del Tai Chi Chuan rispetto ad altre terapie per il rinforzo dell’equilibrio ha un effetto positivo sulla diminuzione del numero di cadute (Winser et al., 2018).
Terapia farmacologica
Tre revisioni meno recenti (Batchelor et al., 2010; Batchelor et al., 2012; Verheyden et al., 2013) riportano un effetto statisticamente significativo sul numero di cadute rispettivamente in donne che assumono vitamina D o individui trattati con bifosfonati. Tuttavia, nella revisione più recente (Denissen et al., 2019), gli studi che hanno messo in luce questi benefici (Sato et al., 2005; Sato et al., 2011) sono stati esclusi dall’analisi; il primo (Sato et al., 2005) perché la pubblicazione relativa è stata ritirata, il secondo (Sato et al., 2011) perché è stata messa in dubbio la sua validità.
Modelli di cura
Non si riscontra una riduzione significativa del numero di cadute confrontando la valutazione pre-dimissione tramite visita domiciliare con quella eseguita in ambito ospedaliero (Denissen et al., 2019).
Ausili di supporto
Se alle persone con ictus portatrici di occhiali con lenti multifocali vengono proposti occhiali con lenti monofocali per la visione a distanza non si osserva alcuna differenza significativa nel numero di cadute (Verheyden et al., 2013; Denissen et al., 2019). Non si registrano effetti neanche a seguito dell’utilizzo di un deambulatore servoassistito (Denissen et al., 2019).
Altri interventi
L’applicazione di una stimolazione transcranica a corrente diretta continua (tDCS) sembra avere un effetto positivo sulla riduzione del numero di cadute (Denissen et al., 2019).
DISCUSSIONE
Implicazioni per la pratica
Quali sono i fattori di rischio che favoriscono l’insorgenza di cadute?
Allo stato attuale delle conoscenze, i soli fattori di rischio di cadute nei soggetti con ictus con forte supporto empirico sono la compromissione dell’equilibrio, l’eminattenzione visuospaziale e il deficit di autocura. Il supporto empirico nei confronti del deterioramento cognitivo e del grado di compromissione motoria nell’emiparesi è ancora equivoco, mentre ad esempio il supporto in favore del tipo di ictus, della sua collocazione anatomica, dell’età, del sesso, dei disturbi motori del linguaggio e di una precedente storia di cadute è debole o assente. I limiti espressi dagli studi primari in termini di rappresentatività e/o dimensione dei campioni di soggetti analizzati e la mancanza di univocità nelle definizioni di costrutti come emiparesi o compromissione motoria sono aspetti che possono aver contribuito ai risultati contrastanti sul ruolo di questi potenziali fattori di rischio, così come l’eterogeneità degli strumenti di valutazione della performance cognitiva può avere impedito di comprendere il reale impatto del deterioramento cognitivo sulle cadute (Campbell, Matthews, 2010). Il fatto che diversi studi abbiano escluso i pazienti gravemente disartrici ha limitato le eventuali inferenze sull’effetto di una comunicazione inefficace (Campbell, Matthews, 2010; Sullivan et al., 2020).
Nonostante lo sviluppo di numerosi strumenti di valutazione del rischio di caduta, è difficile l’identificazione dei pazienti più suscettibili. Per i pazienti colpiti da ictus non si dovrebbe fare affidamento sul punteggio di un particolare strumento, perché attualmente non ne esiste uno di sensibilità e specificità sufficienti. Dal momento che il rischio di cadute per le persone con ictus è frutto di una combinazione di fattori sia preesistenti che associati alla condizione patologica, sarebbe auspicabile identificare ambedue le classi di fattori utilizzando uno strumento di valutazione del rischio specifico e adatto al tipo di setting oggetto di indagine (ospedale, centro di riabilitazione, domicilio) (Batchelor et al., 2012).
Occorre considerare inoltre che il rischio di cadute è di natura multifattoriale ed è una variabile che si modifica dinamicamente nel tempo: può ad esempio esacerbarsi in concomitanza con problemi di salute acuti, cadute ricorrenti o bassi livelli di attività tali da favorire il decondizionamento (Batchelor et al., 2012). Ciò detto, non è sempre possibile prevenire una caduta; uno studio (Teasell et al., 2002) relativo alle cadute occorse in un reparto neurologico ha mostrato che solo il 17% di esse poteva essere evitato.
Quali sono gli interventi implementati per prevenire le cadute e quale la loro efficacia?
Gli interventi presenti in letteratura si possono suddividere nelle seguenti classi: terapia fisica, terapia farmacologica, modelli di cura, ausili di supporto, altri interventi. La disciplina marziale del Tai Chi Chuan sembra essere in grado di diminuire il numero di cadute post ictus, così come la terapia fisica in generale, ma solo in fase acuta. Un intervento promettente, il cui beneficio necessita di ulteriori prove, è l’applicazione della stimolazione transcranica a corrente diretta continua. Le altre classi di intervento non mostrano per ora un effetto sul numero di cadute.
Le possibili ragioni per la carenza di risultati significativi sono correlabili al tipo di intervento e alla misurazione dei risultati. I singoli interventi potrebbero non essere efficaci nelle persone con ictus quanto interventi complessi o multicomponente, che considerano nella loro interezza la natura multifattoriale delle cadute; inoltre spesso il loro numero è considerato un outcome secondario, quindi è plausibile che gli studi primari non siano dimensionati per avere una potenza sufficiente a rilevare un effetto su questo esito (Batchelor et al., 2010).
La stessa definizione di caduta non è univocamente descritta, il che determina differenze nelle modalità di misurazione e segnalazione (Batchelor et al., 2010; Denissen et al., 2019). Per quanto concerne gli interventi afferenti alla classe terapia fisica, con il termine ‘esercizio’ gli studi intendono un’ampia gamma di attività, che però non sempre sono illustrate nel dettaglio; questo rende difficile valutare l’efficacia dei trattamenti al modificarsi di aspetti chiave come caratteristiche, ciclicità, frequenza e intensità (Denissen et al., 2019).
Implicazioni per la ricerca
Una volta che i problemi di equilibrio, l’eminattenzione e il deficit di cura di sé sono riconosciuti come fattori di rischio a forte supporto empirico, occorre valutare quanto essi spieghino, da soli o insieme, la variabilità osservata nel numero di cadute tra i pazienti con ictus (Campbell, Matthews, 2010). Dal momento che i test generali di valutazione delle abilità cognitive producono risultati equivoci, forse può essere produttivo soffermarsi sui domini cognitivi più di frequente influenzati dall’ictus (Campbell, 2010), come ad esempio la disfunzione esecutiva (Cavanagh et al., 2002), che colpisce un soggetto ogni due sopravvissuti (Zinn et al., 2007). Essa si manifesta con tratti di disinibizione, ridotta capacità di pensare in modo astratto o sintetizzare le informazioni, perseveranza verbale o motoria, incapacità di passare da un’attività, comportamento o costruzione a un altro e difficoltà nel mettere in sequenza pensieri e azioni (Leeds et al., 2001); questi caratteri distintivi potrebbero essere responsabili di una quota importante di cadute. Inoltre, sebbene la presenza di disturbi motori del linguaggio lievi o moderati potrebbe non aumentare il rischio di caduta, l’esclusione di persone con grave disabilità comunicativa potrebbe aver condotto ad una sottostima dell’impatto di questo fattore di rischio, di cui peraltro soffrono quasi nove soggetti su dieci (O’Halloran et al., 2009); l’effetto finale è una lacuna di conoscenze in merito alla sussistenza e al ruolo di tali disturbi sulle cadute. Da ultimo, potrebbero essere necessari interventi di prevenzione delle cadute che comprendano strategie mirate in funzione di particolari sottogruppi di persone, setting di cura, tipo di deficit neurologico (Denissen et al., 2019).
Limiti
Le principali fonti di errore sistematico (bias) rilevate dagli autori delle revisioni incluse negli studi primari analizzati sono dovute a: non cecità dei ricercatori, dei pazienti o dei valutatori (Batchelor et al., 2010; Denissen et al., 2019; Verheyden et al., 2013; Winser et al., 2018); non chiarezza sulle modalità di generazione e occultamento della sequenza di allocazione dei pazienti nei gruppi di studio (Batchelor et al., 2010; Winser et al., 2018); analisi non condotte secondo una base di intention-to-treat. (Batchelor et al., 2010; Winser et al., 2018). Tali fonti di bias potrebbero avere generato una sovrastima degli effetti dei trattamenti. Per quanto concerne i limiti dell’overview, non è stata eseguita una valutazione di qualità e rigore metodologico delle revisioni incluse. Inoltre, nonostante la consultazione delle principali banche dati biomediche, del motore di ricerca Web of Science e del registro delle revisioni sistematiche PROSPERO tramite l’utilizzo di una strategia di ricerca comprendente sia termini MeSH che parole chiave, oltre alla non applicazione di filtri relativi a data o lingua di pubblicazione, non è stata consultata la letteratura non pubblicata. Ciò potrebbe avere escluso documenti potenzialmente pertinenti e rilevanti per l’argomento trattato.
CONCLUSIONI
Sebbene le cadute nei soggetti con ictus siano comuni, le prove a supporto dei fattori di rischio non sono ancora conclusive, il che pone difficoltà nell’istituzione e implementazione di strumenti di valutazione mirati e affidabili, con ovvie conseguenze sulla possibilità di ridurre almeno una quota degli eventi. Anche se in alcuni casi (es. Tai Chi Chuan) gli interventi singoli si sono mostrati efficaci, sarebbe auspicabile l’implementazione di strategie multicomponente, per affrontare in modo comprensivo l’intero corredo di deficit cognitivi, sensoriali e motori che accompagnano l’ictus e che nel loro complesso concorrono all’incremento del rischio di caduta.
Conflitto di interessi
Si dichiara l’assenza di conflitto di interessi.
Finanziamenti
Gli autori dichiarano di non aver ottenuto alcun finanziamento e che lo studio non ha alcuno sponsor economico.






