Introduzione
L’ipotermia terapeutica è quel trattamento che prevede l’abbassamento della temperatura corporea ad un range di 32-34 gradi °C nei pazienti vittime di arresto cardiaco che con la ripresa del circolo spontaneo restano in uno stato di incoscienza (GCS<8); scopo del trattamento è quello di ridurre i danni neurologici che si presentano nella fase di ri-perfusione dopo ROSC. L’importanza di questo trattamento è conosciuta sin dal 1800 anche se soltanto a partire dal 2005 l’American Heart Association (AHA) ha incluso l’ipotermia terapeutica nelle linee guida della rianimazione cardiopolmonare. Infine, nelle linee guida del 2015-2020 l’ ERC ha tramutato il termine “ipotermia terapeutica” con “temperatura target”, ha sottolineato la sua importanza e descritto le varie fasi in cui si articola. Queste sono sostanzialmente 3: induzione, mantenimento e ritorno alla normotermia.
Induzione:
Prima di iniziare il trattamento, deve essere preventivamente valutata l’idoneità del paziente a ricevere il trattamento.
I criteri di inclusione sono:
- inizio delle manovre rianimatorie entro 15 minuti dal sospetto arresto cardiaco;
- arresto cardiaco ritenuto di origine cardiaca, compresa l’asistolia, l’attività elettrica senza polso, la tachicardia ventricolare senza polso o la fibrillazione ventricolare;
- ripresa del circolo con pressione sistolica PA > 80 mmHg per un tempo > di 5 minuti dal ripristino del ROSC, anche con amine;
- meno di 60 minuti tra sospetto arresto cardiaco e ROSC;
- il raffreddamento può essere iniziato entro 6 ore dal ROSC;
- ventilazione meccanica;
- stato di coma: paziente non in grado di seguire semplici comandi con Glasgow Coma Scale ≤ 8;
- età di 18 anni o più;
- assenza di gravidanza in atto.
Condizioni che escludono l’applicazione di tale trattamento sono:
- arresto cardiaco con ripristino immediato delle normali funzioni cerebrali;
- arresto cardiaco recuperato in pazienti terminali o con prognosi scadente;
- arresto cardiaco in stato di coma preesistente;
- tempo dalla ripresa del circolo spontanea > 6 ore;
- coagulopatia nota o sanguinamento in atto (non indotta da farmaci);
- lesione emorragica cerebrale;
- gravidanza;
- storia di chirurgia maggiore recente (< 72 h);
- t < 30°C;
- grave infezione sistemica;
- trauma maggiore e ustioni estese. (Baylor University 2010).
Nella letteratura non vi sono riferimenti specifici sul metodo specifico da usare per ottenere un raffreddamento ottimale; tuttavia, qualsiasi sia il metodo adottato l’elemento fondamentale è il raggiungimento repentino della temperatura di 32 °C. L’induzione può essere ottenuta con metodi esterni o interni (Tabella 1).
Tabella 1 – Le tecniche di raffreddamento
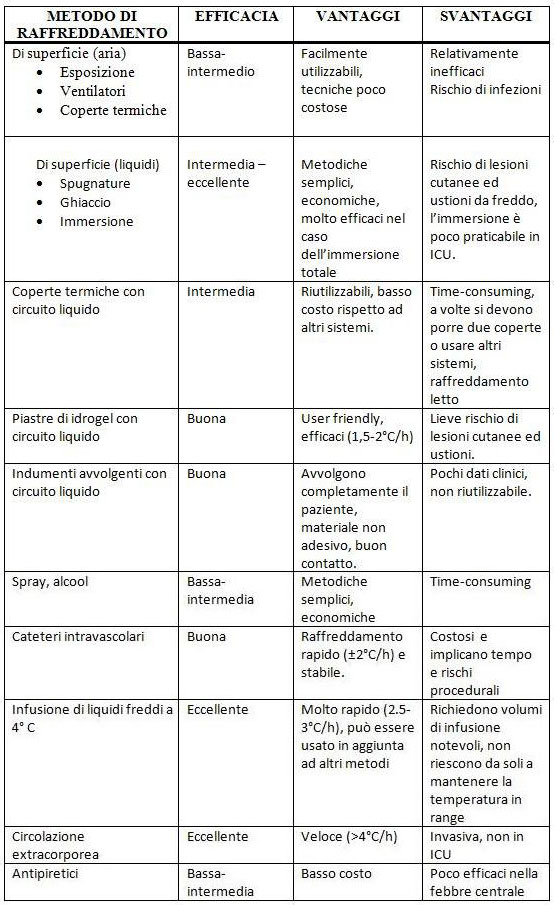
Affinché un ipotermia iniziata già all’interno delle ambulanze possa continuare senza interruzioni all’arrivo in ospedale, alcuni presidi ospedalieri hanno adottato un nuovo codice di accesso: “codice H”. All’arrivo in ospedale in tal modo la vittima riceverà un assistenza adeguata per il proseguo del trattamento ipotermico.
Mantenimento:
Il mantenimento è la fase dove avviene la gestione della temperatura target: è onere dell’infermiere controllare la temperatura e mantenerla al valore costante di 33±1 °C per circa 24 ore. Il mantenimento si esplica fondamentalmente con i mezzi usati per l’induzione; si consiglia però in tale fase di evitare la somministrazione di soluzioni fredde per evitare squilibri emodinamici. Il corretto mantenimento presuppone un corretto controllo della temperatura tramite l’ausilio di diverse tecniche. Il monitoraggio può avvenire tramite l’ausilio di devices posti a livello timpanico, vescicale, esofageo ed endovasale; lo scopo principale è il mantenimento della temperatura target qualsiasi sia il metodo di controllo utilizzato. Alcuni autori consigliano l’utilizzo di 2 tecniche contemporaneamente per un maggior controllo. I rilevatori di maggior semplicità d’uso sono posti a livello timpanico. Forniscono un buon valore della reale temperatura cerebrale ma tuttavia risentono molto di possibili ostruzioni a livello timpanico e del raffreddamento del viso: se si raffredda il viso, il misuratore timpanico rileverà un abbassamento della temperatura che sarà però solamente esterno e non realmente significativo di un abbassamento interno (quello voluto). Possibili artefatti sono riscontrabili anche con i misuratori vescicali che possono essere influenzati dal flusso urinario. Un buon compromesso tra la semplicità d’uso e l’affidabilità è costituito dalla sonda esofagea posta al terzo medio ad una profondità di circa 32-34cm. I devices endovasali sono anch’essi molto precisi. Il controllo della temperatura è un elemento fondamentale anche nella fase successiva: il ritorno alla normotermia.
Riscaldamento:
Questa fase dura in media dalle 8 alle 12 ore. Il riscaldamento deve comunque avvenire ad una velocità non superiore ai 0,25-0,5 °C/ora fino al raggiungimento della normotermia (36,5). Il riscaldamento può avvenire in maniera passiva o tramite l’ausilio di devices esterni o endovascolari. Mantenere la normotermia per almeno 72 ore dopo il ritorno al circolo spontaneo, e se il paziente presenza rialzo termico (superiore ai 37 °C) ricorrere agli strumenti di ipotermia e agli antipiretici. “Diversi studi hanno evidenziato un associazione tra presenza di febbre nel post-arresto cardiaco e prognosi infausta (BaileY ED, 2000)”. Durante tale fase è opportuna una costane valutazione emodinamica del paziente che, proprio in tale fase potrebbe maturare dei significativi cambiamenti minando la prognosi dell’intero processo.
Subito dopo il ritorno alla normotermia è opportuno valutare le condizioni generali del paziente, e in particolar modo soffermarsi sull’aspetto neurologico: “Il processo di recupero cerebrale a seguito di lesione globale post-anossica è completo entro 72 ore dall’arresto nella maggioranza dei pazienti Joglar JA, 1999)”. Prima di un corretto esame neurologico occorre eliminare i cosiddetti “fattori confondenti”: sedazione e miorisoluzione, ipotermia, ipoglicemia, ipotensione grave, disordini metabolici e respiratori.
Revisione della letteratura
Obiettivo: l’obbiettivo di questo studio è stato mettere in risalto con l’ausilio di una revisione sistematica della letteratura, la reale efficacia della temperatura target dopo arresto cardiaco e il ruolo di primordine dell’infermiere in tale trattamento se fornito di protocolli e mezzi validi.
Materiali e metodi: Il metodo utilizzato è quello P.I.C.O. (Tabella 2).
Tabella 2 – Il PICO

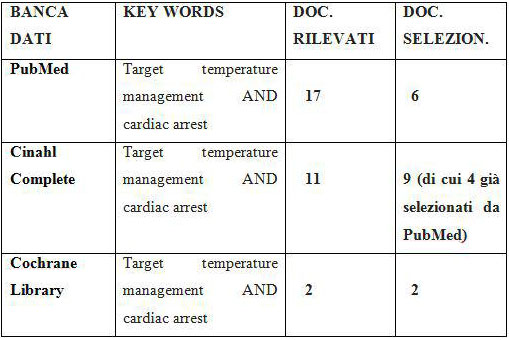
Per reperire il materiale è stata effettuata una ricerca attraverso internet, dalle pagine del centro di Ateneo per le Biblioteche della Federico II. Le parole chiave utilizzate sono state: “Target temperature management” e “cardiac arrest” unite dall’operatore booleano “AND”. Le Banche Dati (BD) consultate sono le seguenti:
- BD Generali: PUBMED, CINAHL COMPLETE
- BD di revisioni sistematiche: COCHRANE LIBRARY.
I criteri di selezione sono stati i seguenti: Pertinenza con il tema (sono stati esclusi documenti poco o molto specifici rispetto alle domande di ricerca), revisioni sistematiche, RCT, studi trasversali, studi pubblicati dopo il 2011 e età superiore ai 18 anni (Tabella 3).
Tabella 3 – Il numero degli articoli selezionati
Risultati della revisione
- La sopravvivenza e i danni neurologici sono ridotti nei pazienti trattati con ipotermia. L’utilizzo di questa procedura, come sostenuto anche dalle recenti linee guida, ha inconfutabili effetti benefici. Al trattamento è associato un lieve aumento di incidenza di polmonite (Arrich J, 2016).
- L’ipotermia mostra essere un valido mezzo per ridurre i danni neurologici post-arresto. Tuttavia non esistono al momento abbastanza studi che dimostrano i benefici di trattamento iniziato a livello pre-ospedaliero (Arrich J, 2016).
- Una temperatura target di 33 gradi °C rispetto ai 35 gradi °C esercita effetti emodinamici benefici e potrebbe essere considerato come terapia aggiuntiva inotropa evitando gli effetti collaterali indesiderati delle sostanze vasoattive (Forkmann M, 2015).
- L’età aumenta sensibilmente la prognosi infausta e la mortalità, tuttavia non esiste correlazione con ipotermia (Winther-Jensen M, 2015).
- L’NSE (Enolasi neurone-specifica) è un ottimo valore prognostico del danno neurologico. Tuttavia il suo valore non risulta influenzato dal trattamento ipotermico (Stammet P, 2015).
- Un ritmo inizialmente non defibrillabile è predittivo di una prognosi infausta. La temperatura target ° migliora poco significativamente l’esito (Frydland M, 2015).
- La bradicardia è un buon marker di esito positivo nel corso del trattamento sia in termini di sopravvivenza che di outcome neurologico. Tuttavia si presenta quasi sempre nei giovani (57 ± 14anni) che non hanno pregresse patologie cardiache (Thomsen JH, 2015).
- La riduzione dell’infiammazione sistemica appare avere un ruolo decisivo se si vuole ottenere una riduzione della mortalità; gli studi a tal proposito sono ancora scarsi (Bro-Jeppesen, 2015).
- Grazie ad un confronto con un gruppo di controllo (infarto senza arresto) si è visto che con l’arresto c’è un deterioramento cognitivo lieve che non varia con le due diverse temperature target (Lilja G, 2015).
- Nei pazienti in shock moderato dopo ROSC non è risultato un significativo miglioramento emodinamico in confronto con un gruppo di pazienti non sottoposti a ipotermia. Solamente il lattato sierico e punteggio SOFA leggermente migliorati (Annborn M, 2014).
- I fattori ritardanti sono stati: tempo impiegato per un paziente di essere valutato da un medico, tempo per avviare l’ipotermia moderata, il tempo per passare da ipotermia moderata a temperatura target. Inoltre, è stato scoperto che la tecnologia utilizzata per l'induzione dell’ipotermia moderata rallenta notevolmente il processo (Carriere SA, 2014).
- Gli interventi passivi come progetti educativi e protocolli specifici aumentano il raggiungimento rapido della temperatura target (Morrison J, 2015).
- Una giuria di esperti che ha analizzato il trattamento, ha evidenziato la sua importanza suggerendo di effettuare sempre valutazioni precise dei cambiamenti indotti dal trattamento per favorire l’avanzamento delle conoscenze su tale argomento (Nunnally E, 2011).
Conclusioni
Il trattamento ipotermico, come ampiamente descritto in letteratura mostra essere uno strumento indispensabile per i casi sopra citati, nel ridurre il danno neurologico. Da tale revisione, emerge altresì che l’infermiere è la persona che più sta a contatto col paziente sottoposto a ipotermia terapeutica, dalle primarie manovre rianimatorie alla conclusione del trattamento, dove l’infermiere risulta fondamentale per il monitoraggio delle funzioni vitali, il riconoscimento e la gestione di possibili complicanze, la valutazione dello stato neurologico e il sostegno bio-psicosociale dell’assistito e dei suoi familiari prendendosi cura in maniera olistica del paziente. Nel corso della stesura di tale revisione sono emerse diverse carenze fondamentali che rendono una chimera l’intero trattamento:
- l’assenza di protocolli operativi che permettano all’infermiere di agire in maniera autonoma e sicura nel corso dell’intero trattamento per rispondere attivamente alle esigenze del paziente;
- la carenza di un equipè con conoscenze e formazione adeguate all’espletamento del trattamento e di presidi idonei per l’attuazione dello stesso nelle strutture ospedaliere di tutto il territorio.






